| Titel: | Ueber drei neue Soda-Salze. Von Thom. Thomson, M. D. F. R. S. |
| Fundstelle: | Band 20, Jahrgang 1826, Nr. XV., S. 54 |
| Download: | XML |
XV.
Ueber drei neue Soda-Salze. Von Thom. Thomson, M. D. F. R.
S.
Aus den Annales of Philosophy. Decbr. 1825. S.
435.
Mit Abbildungen auf Tab.
I.
Thomson, über drei neue Soda-Salze.
Die Zahl der, von den Chemikern mit mehr oder weniger Aufmerksamkeit untersuchten,
Salze belaͤuft sich schon auf mehr als 840. So groß diese Zahl auch scheinen
mag, so betraͤgt sie doch nur einen geringen Theil jener salzartigen
Verbindungen, deren Bildung moͤglich ist. Wir koͤnnen kaum eine der
gewoͤhnlichsten Substanzen mit irgend einiger Aufmerksamkeit untersuchen,
ohne auf neue und unvorhergesehene Erscheinungen zu stoßen. Die Kenntniß der
salzartigen Verbindungen, und der Graͤnzen, welche dieselben beschranken,
sind so wichtig, daß wir nicht im Stande sind, im Allgemeinen uͤber diesen
Gegenstand zu urtheilen, Taͤglich zeigen sich uns Verbindungen, welche offenbar von unseren
vorgefaßten Begriffen abweichen. Gibt es, z.B. eine Meinung, die fuͤr
feststehender gaͤlte, als diese, daß die salzartige Verbindung von
Schwefelsaͤure und Soda nicht krystallisiren kann, ohne sich mit einer
bedeutenden Menge Wasser zu verbinden? Und dennoch habe ich neuerlich mit dieser
Saͤure und dieser Basis vollkommene, wasserfreie Krystalle in bestimmten
Verhaͤltnissen dargestellt.
Die kaͤufliche Soda enthaͤlt jedes Mahl etwas Schwefelsaͤure und
Eisen. Ich bereite mir daher meine Salzsaͤure zu Analysen dadurch, daß ich so
lange salzsaures Gas durch destillirtes Wasser stroͤmen lasse, als dieses
noch etwas davon aufnimmt. Das gewoͤhnliche Salz, aus welchem ich das
salzsaure Gas entwikle, wird in eine große Retorte gebracht, und hierauf die, zur
Zersezung noͤthige, Schwefelsaͤure, nach und nach durch die Tubulatur
eingetragen. Die Retorte wird durch eine Lampe erhizt.
Auf diese Weise entwikelt sich anfangs eine große Menge Gases, welches aber gradweise
abnimmt, und zulezt ganz aufhoͤrt, ehe noch alles Kochsalz in schwefelsaure
Soda verwandelt ist. Die vollkommene Zersezung kann auch nur mit so vieler Arbeit,
und durch Wiederholung so vieler Processe geschehen, daß ich es nicht der
Muͤhe werth finde, sie weiter als bis auf einen gewissen Punct fortsezen. In
der Retorte bleibt ein verhaͤrtetes, weißes und sehr sauer schmekendes Salz,
welches, ich dadurch aufloͤse, daß ich die Retorte mit Wasser fuͤlle,
und im Sandbade digerire. Diese ruͤkstaͤndige Salzmasse ist so schwer
aufloͤslich, daß wiederholtes Digeriren und sehr viel Wasser noͤthig
ist, um dieselbe aus der Retorte zu entfernen. Wird die erste, auf diese Weise
erhaltene, Aufloͤsung, welche viel uͤberschuͤssige
Schwefelsaͤure aufgeloͤst enthaͤlt, im Sandbade concentrirt,
und dann der Krystallisation uͤberlassen, so entstehen anfangs Krystalle,
welche der Form nach dem Glaubersalze sehr aͤhnlich, aber viel fester und
schwerer sind, und einen ausgezeichnet sauren Geschmak besizen. Diese Krystalle
erscheinen nicht immer, und ich konnte die Umstaͤnde nicht ausmitteln, unter
welchen sie sich bilden: wahrscheinlich steht aber ihre Bildung mit dem
Verhaͤltnisse der, in der Fluͤßigkeit enthaltenen
uͤberschuͤssigen. Saͤure in Verbindung. Ich erhielt sie einige
Mahle unter den eben angegebenen Umstaͤnden, und habe keinen Grund zweifeln,
daß andere Chemiker bei
demselben Verfahren sie nicht ebenfalls erhalten sollten. Diese Krystalle bilden ein
neues wasserfreies Salz, welches ich nach seinen Bestandteilen Soda-Sesquisulphat nennen, und dessen Eigenschaften und Analyse hier kurz
angeben will.
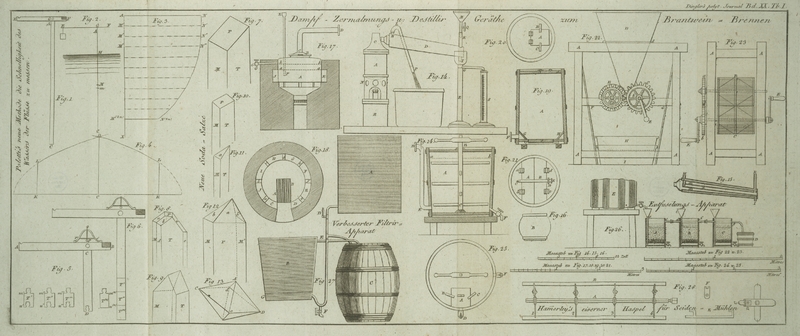
Die Grundform des gewoͤhnlichen Soda-Sulphates Fig. 7. ist ein doppelt
schiefes vierseitiges Prisma mit folgenden Winkeln:
M
auf
T:
108°
P
auf
T
101° 30
P
auf
M
128° (mit einem gewoͤhnlichen Goniometer
gemessen.)
Die scharfen Kanten des Prisma sind oft abgestumpft, so daß ein sechsseitiges. Prisma
entsteht. Die Krystalle des Soda-Sesquisulphates sind anfangs vollkommen
durchsichtig, allein ich erhielt sie nie in einem Zustande, der die Messung
derselben gestattete.
Ich halte die Grundform fuͤr ein gerades vierseitiges Prisma. Die zwei Formen,
welche ich bemerkte, sind Fig. 8 und 9. abgebildet. Fig. 7. ist ein
achtseitiges Prisma, an dessen Ende eine vierseitige Pyramide ist, welche statt der
Spize den Rhombus, P, hat. Die Neigung von M, auf T betraͤgt
90°. Ich halte daher, M und T, fuͤr zwei Grundflaͤchen des
urspruͤnglichen geraden vierseitigen Prisma. Die Flaͤchen, d, e, entstehen durch Abstumpfung der Kanten der
Grundform. P, betrachte ich als einen Ueberrest der
urspruͤnglichen Endflaͤche des Prisma. Die Stellung derselben ist
schief; ich war jedoch nicht im Stande sie zu messen. Die vier pyramidalen
Flaͤchen, a, b, c, entstehen durch Abstumpfung
der Endkanten des urspruͤnglichen Prisma. Ich fand keinen Krystall, der der
Figur 9.
vollkommen aͤhnlich gewesen waͤre. Die Seitenkanten der Grundform sind
immer abgestumpft; die Fig. 9. dargestellte
zweiflaͤchige Spize kommt jedoch zuweilen vor: sie entsteht offenbar durch
Abstumpfung zweier Kanten an der Basis der Grundform. Sehr haͤufig kommen die
in diesen zwei Figuren dargestellten Modifikationen zusammen vor, wodurch die
abgestumpfte Endpyramide 7 Flaͤchen statt 5 erhaͤlt.
Der Geschmak des Salzes ist sehr sauer. Legt man einen Krystall auf Flußpapier, so
wird dieses feucht und sauer, und bleibt auch so, obwohl der Krystall nicht merklich
Feuchtigkeit anzieht, sondern hart und fest, und auf der Oberflaͤche
vollkommen troken bleibt. Das Papier bleibt auch troken, wenn man die Krystalle mit Wasser
abwaͤscht. Das Salz zeigte nicht die geringste Neigung zur Verwitterung,
obwohl es bei troknem Wetter mehrere Tage lang der Luft ausgesezt war.
Das specifische Gewicht des Salzes betraͤgt, bei 63° F., 2, 26. Ich
bestimme das specifische Gewicht der in Alkohol unaufloͤslichen, Salze, indem
ich eine enge graduirte, Roͤhre bis zu einem bestimmten Puncte mit Alkohol
fuͤlle, und eine bestimmte Menge der Krystalle (40 Gran z.B.) in dieselbe
bringe, deren Volumen sich daraus ergibt, daß man beobachtet, um wie viel die
Oberflaͤche des Alkoholes steigt. Aus diesen Daten laͤßt sich, da man
weiß, daß das Gewicht des hundertsten Theiles eines Kubik-Zolles Wassers,
62°, 2,5272 Gran betraͤgt, leicht die specifische Schwere des Salzes
berechnen. Denn, sind z.B. 40 Grane des Salzes ein Equivalent fuͤr das
Volumen von 10/100 eines Kubik-Zolles, oder 25,272 Gran Wasser, so betraͤgt
die specifische Schwere desselben 1,58.
Bei einer Temperatur von 63° F. loͤsen 100 Theile Wasser uͤber
25 Theile dieses Salzes auf. Die Krystalle wurden hierzu vorher gepuͤlvert,
und die Aufloͤsung dadurch bewirkt, daß man 10 Theile des Salzes in einer
Glasroͤhre mit 100 Theilen Wasser schuͤttelte. Nach Aufloͤsung
dieser 10 Theile wurden neuerdings 10 zugesezt. Zwanzig Theile loͤsten sich
auf diese Weise vollkommen auf; allein nach Aufloͤsung der Haͤlfte der
dritten 10 Theile beginnen sich Krystalle in der Fluͤßigkeit zu bilden, und
sich auf den Boden derselben zu sezen, wodurch dem Processe ein Ende gemacht wurde.
Die Krystalle sind gewiß gewoͤhnliches Soda-Sulphat; denn wir wissen aus Gay-Lussac's Versuchen, daß, bei einer Temperatur von
64° F., 100 Theile Wasser nur 16,73 Theile wasserfreies
Soda-Sulphataufloͤsen; 25 Theile Soda-Sesquisulphat enthalten aber 19,5
wasserfreies Sulphat. Scheidet man daher das Soda-Sulphat durch Krystallisation aus
der Fluͤßigkeit ab, so bleibt eine sehr saure Fluͤßigkeit
zuruͤk.
Erhizt man Soda-Sesquisulphat im Sandbade, so schmilzt es nicht, erleidet auch sonst
keine Veraͤnderung, und verliert nur sehr wenig an Gewicht; 40 Grane erleiden
bei dieser Behandlung einen Gewichts-Verlust von 1,2 Gran. Selbst wenn man dasselbe
in einem Platinna-Tiegel bis zum Rothgluͤhen erhizt, ist der Gewichts-Verlust
unbedeutend. Es wurde hierauf mit einer hinlaͤnglichen Menge
Ammonium-Carbonat vermengt, und solang uͤber einer Weingeist-Lampe erhizt,
bis nichts mehr davon
ging. Vierzig Gran erlitten bei dieser Behandlung einen Verlust von 8,7 Gran. Die
ruͤkstaͤndigen 31,3 Gran gaben sich bei der Untersuchung als
wasserfreies Soda-Sulphat zu erkennen, welches besteht aus:
Schwefelsaͤure
17,38
Soda
13,91
–––––
31,30
Vierzig Gran Soda-Sesquisulphat-Krystalle wurden in Wasser aufgeloͤst, und mit
salzsaurem Baryte gefallt. Der erhaltene schwefelsaure Baryt wog, nachdem er
ausgewaschen, getroknet, und roth gegluͤht wurde, 75 Gran, welche 25,42 Gran
Schwefelsaͤure entsprechen. Zieht man von 25,42. 17,38, die Menge der
Saͤure, ab, welche in 40 Gran neutralem wasserfreien Soda-Sulphat enthalten
ist, so bleiben 8,03, was beinahe der dritte Theil von 25,42 ist. Die Bestandtheile
des Salzes sind also:
Schwefelsaͤure
25,42
oder
7,31
Soda
13,91
–
4,0
Verlust
0,67
–
0,19
–––––
40,00
Wenn der Verlust aus Schwefelsaure besteht, wie es nicht unwahrscheinlich ist, so ist
das Salz wasserfrei, und enthaͤlt:
1 1/2
Atom Schwefelsaͤure
7,5
1
Atom Soda
4,0
–––––
11,5
Da sich in der Fluͤßigkeit, aus welcher ich diese Krystalle erhielt, auch noch
Kochsalz befand, so glaubte ich, es moͤchte vielleicht auch etwas
Salzsaͤure in dem Salze enthalten seyn; allein, bei Pruͤfung einer
verduͤnnten Aufloͤsung dieser Krystalle mit salpetersaurem Silber
zeigte sich kein Niederschlag. Hieraus erhellt, daß sich keine Salzsaͤure in
dem Salze befindet, sondern, daß es bloß aus Schwefelsaͤure und Soda
besteht.
2. Soda-Bisulphat.
Wenn man Glaubersalz in verduͤnnter Schwefelsaͤure aufloͤst, und
nach hinlaͤnglicher Concentration die Aufloͤsung der Krystallisation
uͤberlaͤßt, so schießen zahlreiche durchsichtige prismatische
Krystalle an, welche auf den ersten Anblik dem gewoͤhnlichen Soda-Sulphat
sehr aͤhnlich zu seyn scheinen.
Diese Krystalle zerfließen an der Luft kaum merklich, (wenigstens ist ihre
Zerfließbarkeit sehr gering); legt man sie aber auf Flußpapier, so wird dieses bald feucht, und bleibt
auch so. Das Salz wurde vier Mahl nach einander auf trokenes Papier gebracht, allein
immer wurde dieses wieder feucht. Hieraus schließe ich, daß das Salz etwas Wasser
aus der Luft anziehe.
Die Krystalle bestehen, wenn sie sich unter guͤnstigen Umstaͤnden
bilden, aus vierseitigen Prismen mit schiefer Endflaͤche, wie sie Fig. 10.
zeigt, und kommen den Krystallen der gewoͤhnlichen schwefelsauren Soda so
ziemlich gleich; wahrscheinlich sind die Neigungen der Flächen aber etwas
verschieden, obschon noch keiner der Krystalle mit dem Reflexions-Goniometer
gemessen werden konnte. Alle Krystalle, welche ich beobachtete, sind vierseitige
Prismen. An einigen Krystallen besizt die Endflaͤche die Form der
Flaͤche, a, an Fig. 11. obschon das
Prisma vierseitig ist. Die Lage der Flaͤche, a,
ist, in Hinsicht auf das Prisma, viel schiefer, als die der Flaͤche, P. Sie entsteht also wahrscheinlich durch Abstumpfung
der Endkante der Flaͤche, M. Ich konnte an der,
der Flaͤche, M, entgegengesezten, Seite des
Prisma keine, der Flaͤche, a, entsprechende.
Flaͤche finden, wahrscheinlich ist aber bloß der unvollkommene Zustand der
Krystalle Schuld daran.
Der Geschmak dieses Salzes ist sehr sauer. Haͤlt man einen Krystall in die
Flamme des Kerzenlichtes, so schmilzt derselbe wie ein Stuͤk Eis. Das Salz
schmilzt auch, wenn man es im Sandbade erhizt, und bleibt so lange fluͤßig,
als die Hize nicht uͤber 300° betraͤgt; dabei erleidet es kaum
irgend einen Gewichts-Verlust. 18,5 Gran des auf Flußpapier getrokneten Salzes
wurden in einem kleinen Platinna-Tiegel uͤber der Weingeist-Lampe erhizt, und
so lange roth gegluͤht, als sich noch ein bemerkbarer Rauch entwikelte. Das
Salz schmolz anfangs, sott hierauf, und stieß eine bedeutende Menge schwefelsauren
Dampfes aus. Nach einiger Zeit bekam es eine trokene Kruste, welche bei
erhoͤhter Hize schmolz, und waͤhrend der ganzen weiteren Dauer des
Versuches fluͤßig blieb. Der Gewichts-Verlust betrug 8,1 Gran, und das Salz
roͤthete blaue Pflanzensaͤfte so stark, als vorher. Ich nahm diesen
Versuch in der Absicht vor, um auszumitteln, ob das Soda-Bisulphat ebenso
hartnaͤkig, als das Pottasche-Bisulphat, einen bestimmten Theil der
uͤberschuͤssigen Saͤure zuruͤkhaͤlt; denn es ist
bekannt, daß auf dem Pottasche-Bisulphate durch Erhizen uͤber der
Weingeist-Lampe nicht
alle uͤberschuͤssige Saͤure ausgetrieben werden kann. Wir
sehen, daß sich das Soda-Bisulphat ebenso verhaͤlt.
Das specifische Gewicht dieses Salzes beträgt 1,800. Eine, bei 60° F. mit dem
Salze gesaͤttigte, Menge Wasser wurde in einer Glaskapsel im Sandbade so
lange abgedampft, bis sie keinen Gewichts-Verlust mehr erlitt. 226,7 Gran Wasser,
welche auf diese Weise behandelt wurden, ließen 109,07 Gran Soda-Bisulphat
zuruͤk. Hieraus folgt, daß bei 60° F. 100 Theile Wasser 92,72 Theile
dieses Salzes aufloͤsen. Es ergibt sich ferner aus diesem Versuche, daß das
Soda-Bisulphat bei 60° F. mehr als zwei Mahl so leicht auflöslich ist, als
das Soda-Sulphat; denn wir wissen aus Gay-Lussac's
Tabelle, daß 100 Theile Wasser bei 60° bloß 38,39 Theile Glaubersalz
aufloͤsen.
Zur Ausmittelung der Bestandtheile dieses Salzes wurden 20 Gran desselben, nachdem
sie vorher mit etwas kohlensaurem Ammonium vermengt worden waren, uͤber einer
Weingeist-Lampe in einem, kleinen Platinna-Tiegel so lange erhizt, bis alle
uͤberschuͤssige Saͤure und alles Wasser ausgetrieben war, und
neutrales Soda-Sulphat zuruͤkblieb. Dieses wasserfreie und neutrale Sulphat
wog 9,7 Gran, und bestand aus:
Schwefelsaͤure
5,377
Soda
4,322
–––––
9,7
Zwanzig Gran des Salzes wurden in Wasser aufgeloͤst, und mit salzsaurem Baryte
gefaͤllt. Das dadurch erhaltene Baryt-Sulphat wog, nachdem es ausgewaschen,
getroknet und roth gegluͤht worden war, 30,32 Gran, welche 10,278 Gran
Schwefelsaͤure entsprechen. Nun kommt 10,278 dem Producte von 5,377 ×
2 so nahe, daß beinahe kein Zweifel mehr uͤbrig bleibt, daß das Salz 2 Atome
Schwefelsaͤure enthaͤlt.
Ich fand durch einen Versuch, der sogleich angegeben werden soll, daß die Ursache,
aus welcher die Schwefelsaure, die man durch den salzsauren Baryt erhaͤlt,
nicht genau des Doppelte von der, in dem neutralen Soda-Sulphat enthaltenen,
betraͤgt, von einem Mangel herruͤhrt, welcher hoͤchst
wahrscheinlich von etwas, dem analysirten Salze anhaͤngenden, Wasser
herkommt; denn es ist sehr schwer, das Salz in einem solchem Zustand von Trokenheit
zu versezen, daß es zur Analyse tauglich ist.
Betrachten wir das Salz als ein Bisulphat, und rechnen daher die Saͤure
doppelt so hoch, als in dem neutralen Sulphate von 20 Gran des Salzes gefunden
wurde, so ergeben sich folgende Bestandtheile:
Schwefelsaͤure
10,755
oder
10,0
Soda
4,322
–
4,0
Wasser
4,922
Die Zahlen der zweiten Columne sind die Aequivalente fuͤr die atomischen
Gewichte ihrer Bestandtheile. 4,57 kommt 4 Atomen Wasser so nahe, daß ich mich
fuͤr berechtigt halte, folgende Bestandtheile des Salzes anzugeben:
2
Atome
Schwefelsaͤure
10,0
1
Atom
Soda
4,0
4
Atome
Wasser
4,5
–––––
18,5
Zur Bestaͤtigung dieser Voraussezung wurden 18,5 Gran des Salzes in Wasser
aufgeloͤst, und mit einer Aufloͤsung von 26,5 Gran Barium-Chlorid
vermengt. Nach der Faͤllung des Baryt-Sulphates wurde die daruͤber
stehende Fluͤßigkeit mit Soda-Sulphat und Baryt-Muriat gepruͤft; beide
brachten aber keine Wirkung hervor. Sie enthielt also weder Schwefelsaͤure
noch Baryt, woraus hervorgeht, daß 18,5 das wahre atomische Gewicht des Salzes ist,
und daß folglich die Bestandtheile richtig bestimmt worden waren.
Specifisches
Gewicht
von
wasserfreiem Soda-Sulphat
2,640
–
–
–
krystallisirtem Soda-Sulphat
1,350
–
–
–
Soda-Bisulphat
1,300
–
–
–
Soda-Sesquisulphat
2,260
Es ist sonderbar, daß in diesen drei Salzen sowohl das Krystallisations-Wasser, als
die uͤberschuͤssige Saͤure (in dem Bisulphat und
Sesquisulphat), eine Ausdehnung statt einer Zusammerziehung erlitten; denn
wuͤrde sich das wasserfreie Sulphat und das, in den Soda-Sulphat-Krystallen
enthaltene, Wasser ohne Veraͤnderung des Volumens mit einander verbinden, so
waͤre das specifische Gewicht 1,75 statt 1,35; so daß also das specifische
Gewicht des, in den Krystallen enthaltenen, Wassers bloß 0,318 betraͤgt.
Berechnet man in dem Sesquisulphat die specifische Schwere der Schwefelsaͤure
in der Voraussezung, daß sie sich ohne Veraͤnderung des Volumens mit dem
wasserfreien Sulphate verbindet, so erhaͤlt man 0,9. Wir sind aber gewiß, daß
die specifische Schwere
der wasserfreien Schwefelsaͤure wenigstens 2 ist. Nach Berechnung aus dem
Bisulphat waͤre die specifischespecische Schwere der Schwefelsaͤure 1,01.
Die
specifische
Schwere
des
Pottasche-Sulphates betraͤgt
2,880
–
–
–
–
Pottasche-Bisulphates
2,112
Berechnet man das specifische Gewicht des zweiten Atomes Schwefelsaͤure in dem
Bisulphate, in der Voraussezung, daß das wasserfreie Sulphat, die
Schwefelsaͤure und das Wasser sich ohne Veraͤnderung des Volumens
verbinden, so erhält man 0,923.
Ist es also uͤbereilt aus diesen Thatsachen zu schließen, daß in den neutralen
Salzen das Krystallisations-Wasser, und in sauren Salzen die
uͤberschuͤssige Saͤure das Volumen vergroͤßern statt
dasselbe zu vermindern? Ich koͤnnte noch mehrere Beispiele dieser
Volumen-Vergroͤßerung anfuͤhren, wenn hier der Plaz dazu
waͤre.
3. Prismatisches
Soda-Carbonat.
Ich bemerkte vor einiger Zeit, daß, wenn man die gewoͤhnlichen
oktaëdrischen Krystalle von Soda-Carbonat in der Hize in ihrem
Krystallisations-Wasser zerfließen laͤßt, und dann bei Seite sezt, sich neue
Krystalle von Soda-Carbonat bilden, welche eine andere Form haben, und weniger
Wasser enthalten. Ich gab diese Erscheinung im Allgemeinen im zweiten Bande Seite
267. meiner „Attempt to establish the first
Principles of Chemistry by Experiment“ an. Allein meine
Versuche waren in einem zu kleinen Maßstabe angestellt, als daß ich im Stande
gewesen waͤre, die Form der Krystalle zu bestimmen, oder das Salz einer so
strengen Analyse zu unterwerfen, daß ich diese in meinem Werke haͤtte
aufnehmen koͤnnen; denn obschon ich aus meinen Versuchen schloß, daß das
Wasser sieben oder acht Atome betraͤgt, so gelang es mir doch nicht, dasselbe
auszumitteln.
Mein Freund, Hr. Charles Tennant von Glasgow, welcher
Soda-Carbonat sehr im Großen bereitet, und der seine Fabrication Winter und Sommer
uͤber betreibt, war waͤhrend des heißen Sommers von 1825 gezwungen,
die Krystallisation des Salzes zu hemmen. Ehe diese Untersuchung geschah, sezten
sich in den Abdampf-Gefaͤßen mehrere Krystall-Gruppen ab, welche ihrem
Aussehen nach von den Krystallen des gewoͤhnlichen Soda-Carbonats sehr
verschieden waren. Diese Krystalle zogen die Aufmerksamkeit des Hrn. Thomas Clarke, eines meiner ausgezeichnetsten chemischen
Freunde, der die Aufficht uͤber Hm. Tennant's Laboratorium fuͤhrt,
auf sich. Er sammelte eine bedeutende Menge dieser Krystalle, und unterwarf sie
einer chemischen Analyse, deren Resultat ihn veranlasste die Bestandtheile dieses
Salzes fuͤr 1 Atom Kohlensaͤure, 1 Atom Soda und 7–8 Atome
Wasser zu halten.
Diesem Manne verdanke ich mehr als Ein Pfund sehr regelmaͤßiger und reiner
Krystalle dieses neuen Salzes, dessen Eigenschaften ich nun beschreiben will.
Die Krystalle sind vierseitige Prismen mit vierseitigen Pyramiden an den Enden;
einige derselben sind mehr als 1 1/2 Zoll lang, und 1/4 Zoll dik. An der Luft
verwittern sie nicht, selbst nicht bei sehr trokenem Wetter. Allein mein
Laboratorium, in welchem ich diesen Versuch anstellte, ist feucht, denn das
Glasgow-College, in dessen unterstem Stokwerke sich dasselbe befindet, ist auf
Lehmboden gebaut. Obschon ich mehr als 100 Krystalle sorgfaͤltig untersuchte,
so fand ich doch keinen, dessen Flaͤchen glatt genug gewesen waͤren,
um mit dem Reflexions-Goniometer gemessen werden zu koͤnnen. Mit dem
gewoͤhnlichen Goniometer erhielt ich folgende, Masse, welche der Wahrheit so
ziemlich nahe zu kommen scheinen.
Fig.
12.
M
auf
P
90°
P
auf
M'
90
M
auf
b
115
M'
auf
b'
115
P
auf
a
125
a
auf
b, oder b'
150
Die Grundform laͤßt sich als ein gerades rechtwinkeliges Prisma mit
rechtwinkeliger Basis betrachten.
Das gewoͤhnliche Soda-Carbonat ist ein bipyramidales Oktaëder, dessen
gemeinschaftliche Basis ein Rhombus mit Winkeln von 120° und 60° ist.
Denken wir uns diese Form durch Fig. 13. ABCD, vorgestellt, so haben wir eine Idee von den
gewoͤhnlichen Krystallen dieses Salzes, wenn wir uns die spizigen Winkel, A, B, des Rhombus, der die gemeinschaftliche Basis der
Pyramiden bildet, durch eine Flaͤche abgestumpft denken, welche parallel mit
der Axe des Oktaëders, CD, laͤuft.
Diese Abstumpfungen gehen mehr oder minder tief; allein nie fand ich einen Krystall
ohne dieselben, obwohl ich mehrere hundert Krystalle von jeder Groͤße, von
1/2–8 Zoll Laͤnge, untersuchte.
Das gerade rechtwinkelige Prisma laͤßt sich von diesem Oktaëder ableiten, wenn
man annimmt, daß die 4 Winkel des Rhombus, AcBd,
durch tangentale Flaͤchen ersezt werden; es ist dieß aber nicht
noͤthig, da die beiden Salze in ihren Bestandtheilen von einander abweichen,
und da die pyramidale Endigung von den Enden, C, D, des
rhomboidalen Oktaëders, welches die Grundform des gewoͤhnlichen
Soda-Carbonates ist, ganz verschieden ist.
100 Theile Wasser loͤsen, bei 63° F., 63,87 Theile dieser Krystalle
auf. Dieß betraͤgt etwas mehr, als die Menge gewoͤhnlichen
Soda-Carbonates, welches sich bei derselben Temperatur aufloͤst; denn aus
einer Reihe von Versuchen, welche ich in meinem Laboratorium anstellte, ergibt sich,
daß 100 Theile Wasser, bei 65° F., 51,03 Theile der Krystalle
aufloͤsen.
Beim Erhizen zerfließt dieses Salz zum Theile, aber nicht ganz, wie dieß auch mit dem
oktaĕdrischen Carbonate der Fall ist. Ein Theil bleibt immer fest, und beim
Abkuͤhlen entstehen schnell unvollkommene Krystalle. Dieß fuͤhrt zu
der Vermuthung, daß es noch eine dritte Art von Soda-Carbonat-Krystallen gibt,
welche noch weniger Krystallisations-Wasser enthalten. Sein specifisches Gewicht ist
1,51.
Zur Ausmittelung der Bestandtheile dieses Salzes machte ich verschiedene Versuche,
von welchen ich die wichtigeren kurz angeben will.
1) 50 Gran des Salzes wurden in Wasser aufgeloͤst, und mit
Salpetersaͤure neutralisirt. Die Aufloͤsung wurde mit Baryt-Muriat
untersucht, und zeigte keine Spur Schwefelsaͤure; Silber-Nitrat
faͤllte jedoch Silber-Chlorid, welches 1,58 Gran wog. Dieß ist soviel als
0,39 Gran Chlorine, oder 0,65 Sodium-Chlorid; so daß also 100 Gran des Salzes 1,3
Gran Kochsalz enthalten.
2) 50 Gran des Salzes verloren, der Rothgluͤhhize ausgesezt, bei drei
verschiedenen Versuchen, 28,09 Gran. Da nun das Kochsalz wasserfrei ist, so muß
dieses von dem Gewichte des angewendeten Soda-Carbonates abgezogen werden. Ist dieß
geschehen, so findet man, daß 49,35 Gran reine prismatische Soda in der
Rothgluͤhhize 28,09 Gran verlieren, und daß folglich 100 Theile des Salzes
bei dieser Behandlung einen Gewichts-Verlust von 56,92 Gran erleiden. Dieß ist der
Betrag des Krystallisations-Wassers.
3) In eine kleine Woulfische Flasche mit zwei Muͤndungen, wovon die eine mit Baumwolle
zugestopft war, wurden bei der anderen offenen Muͤndung 50 Gran Krystalle von
diesem Salze gebracht. Die Flasche enthielt eine bestimmte Menge concentrirte und
ungefaͤrbte Salpetersaͤure; sie wurde vorher genau gewogen, und
waͤhrend des Einbringens der Krystalle in schiefer Richtung gehalten.
Unmittelbar darauf wurde die Muͤndung der Flasche zugestoͤpselt, und
die Flasche stehen gelassen, bis die Aufloͤsung erfolgt war. Hierauf wurde
der Stoͤpsel weggenommen, und ein kleines Saugrohr eingebracht, mittelst
welchem ich alle Kohlensaͤure aus der Flasche entfernte, und dafuͤr
der atmosphaͤrischen Luft den Zutritt gestattete. Der durch Entweichung des
kohlensauren Gases entstandene Gewichts-Verlust betrug 8,47 Gran. Wurde
verduͤnnte Schwefelsaͤure statt der Salpetersaͤure genommen, so
war der Gewichts-Verlust immer geringer, weil ein Theil Kohlensaͤure in der
Fluͤssigkeit zuruͤkbleibt, und durch Anwendung der Hize ausgetrieben
wird. Bei zwei, auf diese Weise gemachten. Versuchen betrug der Verlust 8,06 und
8,01 Gran. Aus dem Versuche mit Salpetersaͤure, welcher zwei Mahl angestellt
wurde, erhellt, daß 100 Gran des prismatischen Soda-Carbonates, wenn es rein ist,
17,163 Gran Kohlensaͤure enthalten.
4) 50 Gran des Salzes wurden in Salpetersaͤure aufgeloͤst, und die
Aufloͤsung zur Trokenheit eingedampft. Das erhaltene Soda-Nitrat wog 35,59
Gran, was 12,991 Gran Soda entspricht.
50 Gran wurden in Schwefelsaͤure aufgeloͤst. Die Aufloͤsung
wurde zur Trokenheit eingedampft, und mit etwas Ammonium-Carbonat roth
gegluͤht, um alle uͤberschuͤssige Saͤure zu entfernen.
Das Soda-Sulphat wog 29,73 Gran, was 13,213 Gran Soda gleich kommt.
Die Menge des erhaltenen Soda-Sulphates kann zur Bestimmung der Menge der Soda in dem
Carbonate nicht benuͤzt werden, weil die angewendete Saͤure aus
kaͤuflicher Schwefel-Saͤure bestand, welche nie ganz frei von Blei
ist. Die Soda betraͤgt in 50 Gran des Carbonates, der Bestimmung durch
Salpetersaͤure zu Folge, 12,991 Gran; es enthalten also 100 Gran 25,982 Gran.
Zieht man hiervon die 0,52 Gran Soda ab, welche in dem Kochsalze enthalten ist, das
sich in diesem Salze befindet, so bleiben 25,462 Gran Soda fuͤr 98,7 Gran reinen Carbonates; es
enthalten folglich 100 Gran 25,797 Gran.
Aus diesen Versuchen ergeben sich nun folgende Bestandtheile:
Kohlensaͤure
17,163
oder
2,661
Soda
25,797
–
4,0
Wasser
56,920
–
8,824
––––––
99,380
Verlust
0,12
––––––
100,000
In der zweiten Columne befinden sich die atomischen Aequivalente fuͤr die
Bestandtheile. Betrachtet man den Verlust als Kohlensaͤure, was sehr
wahrscheinlich ist, so ist das Aequivalent fuͤr die Kohlensaͤure 2,68,
was um mehr als 1/40 weniger betraͤgt, als das Gewicht Eines Atomes. Die Soda
befand sich urspruͤnglich in dem Zustande eines Sulphates, und wurde durch
Erhizen mit einem brennbaren Stoffe (gewoͤhnlicher Stein-Kohle) in ein
Sulphuret verwandelt. Das auf diese Weise erzeugte Sulphuret wurde in Wasser
aufgeloͤst, zur Trokenheit eingedampft, mit Saͤgespaͤnen
vermengt, und einer Hize ausgesezt, die stark genug war, um die
Saͤgespaͤne zu verzehren. Auf diese Weise wird der Schwefel
ausgetrieben, und an dessen Stelle tritt Kohlensaͤure. Hrn. Tennant's Soda enthaͤlt gewoͤhnlich eine
geringe Menge Soda-Sulphat, welches offenbar von etwas Schwefel herruͤhrt,
der bei dem Verkohlungs-Processe in Schwefelsaͤure verwandelt wird; das
prismatische Carbonat enthaͤlt aber durchaus keine Schwefelsaͤure, und
ich konnte auch durch Anwendung der empfindlichsten Reagentien keinen Schwefel oder
Schwefelwasser-Stoffgas entdeken. Es bleibt also etwas zweifelhaft, ob der, aus
obiger Analyse hervorgehende, geringe Ueberschuß von Soda einem Irrthume in den
Versuchen, oder dem Umstaͤnde zuzuschreiben ist, daß das Salz eine geringe
Menge Soda-Hydrat mit dem Carbonate vermengt, oder verbunden enthaͤlt.
Der Analogie zu Folge ist 2,75 : 4 = 17,283 : 25,136 = der Soda in Verbindung mit der
Kohlensaͤure, und durch Subtraction von 25,136 von 25,797 erhaͤlt man
0,659 fuͤr die aͤzende Soda, welche in 100 Gran des Salzes enthalten
ist. Diese Soda, vorausgesezt, daß sie vorhanden ist, ist als Hydrat mit 0,185
Wasser verbunden, und betraͤgt dem Gewichte nach 0,844 Gran. Zieht man diese
Mengen von einander ab, so erhaͤlt man 17,283 + 25,138 : 56,735 = 6,75 :
9,027 = dem Wasser, welches in dem Salze mit 6,75 des wasserfreien Soda-Carbonat
verbunden ist.
Ich bin vielmehr geneigt, einen Ueberschuß von Soda, oder ehe die Gegenwart von etwas
Soda-Hydrat in dem Salze anzunehmen, weil ich mir, nachdem ich den Abgang an
Kohlen-Saͤure bemerkt hatte, alle Muͤhe gegeben habe, die Menge der
Kohlensaͤure mit der groͤßten Genauigkeit zu bestimmen; allein alle
Versuche fuͤhrten zu demselben Resultate; berechnet man ferner die
Kohlensaͤure aus dem Soda-Nitrat, so erhaͤlt man beinahe genau
dasselbe Gewicht Kohlensaͤure, wie auf die directe Methode.Es wurde gezeigt, daß 49,35 Gran des reinen Salzes in der Hize 28,09 Gran
verlieren. Die zuruͤkbleibenden 21,26 Gran geben bei Zersezung mit
Kohlensaͤure (12,991 – 0,26) = 12,731 Gran Soda; die 21,26
Gran mußten also bestehen aus:
Kohlensaͤure 8,529Soda12,731–––––21,260Also ist 8,529 : 12,731 = 4 : 2,666 = der Kohlensaͤure, welche in dem
Carbonate mit 4 Soda verbunden ist.
Es scheint also nach obiger Analyse keinem Zweifel mehr zu unterliegen, daß die
prismatische kohlensaure Soda, (vorausgesezt, daß sie rein ist), folgende
Bestandtheile besizt:
1
Atom
Kohlensaͤure
2,75
1
Atom
Soda
4,0
8
Atome
Wasser
9,0
–––––
15,75
Tafeln