| Titel: | Verbesserungen im Reinigen des Leuchtgases und in der Behandlung der ammoniakalischen Producte von Gasanstalten, worauf sich John R. Johnson, Chemiker im Nelson-square, Grafschaft Surrey, am 20. Decbr. 1845 ein Patent ertheilen ließ. |
| Fundstelle: | Band 101, Jahrgang 1846, Nr. XCII., S. 442 |
| Download: | XML |
XCII.
Verbesserungen im Reinigen
des Leuchtgases und in der Behandlung der ammoniakalischen Producte
von Gasanstalten, worauf sich John R. Johnson, Chemiker im Nelson-square, Grafschaft
Surrey, am 20. Decbr. 1845 ein Patent ertheilen ließ.
Aus dem Repertory of Patent-Inventions, Aug. 1846, S.
87.
Mit Abbildungen auf Tab. VII.
Johnson's Verbesserungen im Reinigen des
Leuchtgases.
I. Reinigung des Leuchtgases von Ammoniak
und dessen Verbindungen. Nachdem das Gas die
Condensatoren passirt hat und ehe es in den
Kalk-Reinigungsapparat tritt, enthält es Ammoniak, mit
verschiedenen flüchtigen Säuren, z.B. Schwefelwasserstoff,
Blausäure, Kohlensäure verbunden. Wenn es den
Kalk-Reinigungsapparat passirt hat, sind diese
Verbindungen zersetzt worden, indem sich der Kalk mit den
erwähnten Säuren verband und das Ammoniak frei machte, welches
man dann als Aetzammoniak im Gas findet.
Man hat schon verschiedene Vorschläge gemacht um die
Ammoniaksalze abzusondern; es wurden dazu verdünnte Säuren
benutzt und auch Auflösungen von Metallsalzen, z.B. salzsaures
Mangan. Alle diese Verfahrungsarten haben aber den Nachtheil,
daß man den Druck beträchtlich erhöhen muß, um das Gas durch die
Flüssigkeit zu treiben, und einige erfordern außerdem noch die
Anwendung von Triebkraft, damit die Operation gehörig ausgeführt
werden kann.
Diese Nachtheile beseitige ich und reinige das Gas vollständig
von Ammoniak, indem ich Substanzen anwende, welche die
Eigenschaft haben im trockenen oder festen Zustande das Ammoniak
und dessen Verbindungen zu absorbiren; dieß scheint bei allen
denjenigen der Fall zu seyn, welche es im aufgelösten Zustande
thun, wenn sie nur in gehörig zertheilter oder pulverförmiger
Form angewandt werden und genug Krystallwasser oder
hygrometrische Feuchtigkeit enthalten, damit das Gas und der
feste Körper auf einander wirken können. Man kann die
Substanzen, welche diese Eigenschaft besitzen, in zwei Classen
theilen: 1) solche welche auf die Ammoniak-Verbindungen
nach Art der Säuren wirken, d.h. welche nur das Ammoniak
absorbiren und die Säuren, womit es vorher vereinigt war, frei
machen oder bloß zum Theil absorbiren. In diese Classe gehören
die festen Säuren, wie Phosphorsäure, Boraxsäure, die Salze mit
überschüssiger Säure, z.B. doppeltschwefelsaures Kali, Natron
und Ammoniak, ferner die doppelt-phosphorsauren Salze
dieser Basen; auch die Salze der Thonerde und einiger anderen
Erden; 2) solche Substanzen welche die Ammoniakverbindungen
gänzlich, sowohl deren Säure als Basis absorbiren. In diese
Classe gehören die Metallsalze welche die erforderliche Menge
Wasser enthalten und unter ihnen verdienen die Eisen- und
Mangansalze wegen ihrer Wohlfeilheit den Vorzug.
Ich will nun mein Verfahren bei Anwendung von krystallisirtem
schwefelsaurem Eisenoxydul oder dem im Handel vorkommenden
grünen Eisenvitriol ausführlich beschreiben. Man pulverisirt
denselben; je feiner das Pulver ist, desto vollständiger wird es
durch die Ammoniakverbindungen zersetzt. Dieses Pulver wende ich
gerade so an wie den befeuchteten Kalk in den
Reinigungsapparaten mit trockenem Kalkhydrat; ich breite es
nämlich auf Fächern aus, nur bringe ich die Latten, woraus
dieselben gebildet sind, enger aneinander als es für das
Kalkhydrat erforderlich ist. Der Proceß wird dann gerade so
ausgeführt wie mit letzterem; man läßt nämlich, nachdem der
Deckel herabgelassen und dicht aufgepaßt ist, das Gas
hindurchpassiren, bis ein Stückchen geröthetes Lackmuspapier
anzeigt daß das Material kein Ammoniak mehr absorbirt; wenn
dieser Zeitpunkt eingetreten ist, leitet man das Gas in einen
zweiten eben so vorgerichteten Reinigungsapparat und entleert
den schon gesättigten. Ich habe hier angenommen, daß man
jedesmal nur ein einziges Reinigungsgefäß benutzt, aber es ist
natürlich zweckmäßiger eine Reihe solcher anzuwenden. Nachdem
das Gas dieselben passirt hat, leitet man es in die gewöhnlichen
Kalk-Reinigungsapparate.
Wenn die anzuwendenden Metallsalze nicht ursprünglich genug
Wasser enthalten, muß man ihnen noch solches zusetzen. Der
gepulverte Eisenvitriol z.B., wenn man ihn schwach befeuchtet,
so daß er zusammenhängt, wirkt eben so gut wie außerdem und hält
sich besser auf den Latten.
Behandlung der ammoniakalischen
Flüssigkeit der Gasanstalten. Wenn man dieselben nach
der gewöhnlichen Methode behandelt, entwickelt sich eine große
Menge des übelriechenden und der Gesundheit so schädlichen
Schwefelwasserstoffgases. Um diesen Uebelstand zu beseitigen,
hat man vorgeschlagen die Flüssigkeit mit viel Kalk versetzt zu
destilliren, die Dämpfe zu verdichten und sie dann in eine Säure
zu leiten. Ein anderer Vorschlag besteht darin, die Flüssigkeit
mit oder ohne Kalk abzudampfen und die Dämpfe ohne vorherige
Verdichtung durch Säure zu leiten. Im ersteren Fall fand man bei
Ausführung der Operation in großem Maaßstab, daß der Kalk eine
Kruste bildet oder sich absetzt, wodurch die Ausführung der
Operation sogar gefährlich wird. Im zweiten Fall wird selbst mit
Zusatz von Kalk beim Abdampfen der beabsichtigte Zweck nicht
erreicht, weil das schädliche Gas (Schwefelwasserstoff) dennoch
erzeugt wird, sobald die Dämpfe mit der Säure in Berührung
kommen. Ich beseitige diese Nachtheile, indem ich auf folgende
Weise verfahre.
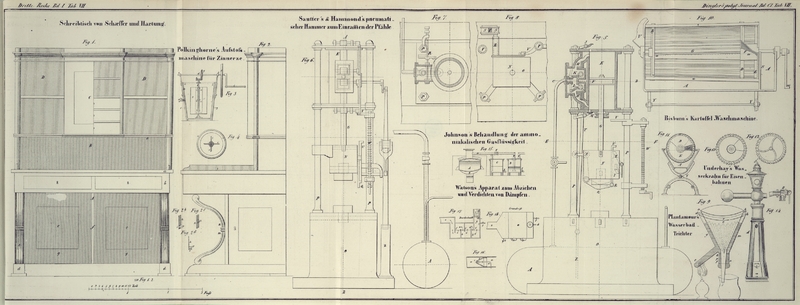
Ich bringe die Flüssigkeit in ein Gefäß A, Fig.
15, ähnlich einem gewöhnlichen Dampfkessel und erhitze
es durch den Ofen B. Die Flüssigkeit
besteht hauptsächlich aus schwefelwasserstoffsaurem und
kohlensaurem Ammoniak, mit kleinen Mengen anderer Ammoniakfalze.
Sobald die Temperatur steigt, geht das schwefelwasserstoffsaure
Ammoniak, als das flüchtigste Product, über. Ich unterhalte ein
schwaches Feuer, um ausschließlich dieses Product zu
verflüchtigen und leite es durch das Rohr a, a in das Gefäß C,
welches eine Auflösung von Eisen- oder Mangansalz oder
Kalkmilch, überhaupt eine Substanz enthält, welche die
Eigenschaft hat das Schwefelwasserstoffgas zu absorbiren. Wendet
man ein Eisen- oder Mangansalz an, so besteht die
Flüssigkeit im Gefäß C (deren eine
Reihe angewandt werden muß), nachdem sie von den Dämpfen
gesättigt worden ist, aus einem Ammoniaksalz, worin
Schwefeleisen oder Schwefelmangan suspendirt ist. Benutzt man
hingegen zum Absorbiren des Schwefelwasserstoffs Kalkmilch, so
wird das Ammoniak frei und muß in ein zweites Gefäß D geleitet werden, welches mit einer
Säure beschickt ist; in diesem Fall wird also, nachdem alles schwefelwasserstoffsaure Ammoniak übergegangen ist, das Gefäß
C Schwefelcalcium und etwas
freies Ammoniak, das Gefäß D aber
eine Auflösung von Ammoniaksalz enthalten.
Die im Kessel zurückbleibende Flüssigkeit, welche hauptsächlich
aus kohlensaurem Ammoniak besteht, kann man auf gewöhnliche
Weise behandeln, nämlich mit einer Säure neutralisiren und dann
in bleiernen Kesseln abdampfen, um die Ammoniaksalze
krystallisirt zu erhalten. Man kann aber auch das Abdampfen im
Kessel bei einer höheren Temperatur fortsetzen, um die
flüchtigen Ammoniaksalze überzutreiben und die Dämpfe durch
Säure leiten, um das Ammoniak zu absorbiren; hiezu läßt sich der
vorher beschriebene Apparat benutzen, nachdem man den Hahn E geöffnet hat. Die Dämpfe ziehen
dann durch das Rohr b und durch die
Säure im Gefäß D (ohne in das Kalk
enthaltende Gefäß C zu gelangen),
worin sie absorbirt werden. Man setzt das Abdampfen fort, bis
die flüchtigen Ammoniaksalze vollständig ausgetrieben sind,
worauf man die Flüssigkeit im Kessel wegschütten kann, es sey
denn daß sie fixe Salze enthält, welche eine weitere Behandlung
derselben lohnen. Um sich darüber Gewißheit zu verschaffen,
dampft man eine Quantität der Flüssigkeit ab und wiegt das
zurückbleibende Salz. Um diese fixen Ammoniaksalze zu gewinnen,
dampft man entweder die Flüssigkeit in einem bleiernen Kessel
gänzlich ab, oder versetzt sie schon in dem Kessel A mit der nöthigen Menge
Schwefelcalcium, welches die fixen Ammoniaksalze zersetzt,
worauf das entstandene schwefelwasserstoffsaure Ammoniak wie
früher überdestillirt werden kann.
Tafeln