| Titel: | Ueber colorimetrische Analyse; von F. Dehms, Techniker der Telegraphen-Bau-Anstalt von Siemens und Halske in Berlin. |
| Autor: | F. Dehms |
| Fundstelle: | Band 172, Jahrgang 1864, Nr. CXIV., S. 440 |
| Download: | XML |
CXIV.
Ueber colorimetrische Analyse; von F. Dehms, Techniker der
Telegraphen-Bau-Anstalt von Siemens und Halske in Berlin.
Mit Abbildungen auf Tab.
VII.
Dehms, über colorimetrische Analyse.
Bei Durchforschung eines Mangankupfererz-Bergwerks hatte ich eine große Zahl von
Proben der Erze der auf Kupfer gerichteten quantitativen
Analyse zu unterwerfen. Da von dem Resultate derselben jedesmal die Richtung
abhängig war, in der die Arbeiten fortgeführt wurden, so erschien das gewöhnliche
Verfahren zu zeitraubend und sann ich auf eine andere Methode der Analyse, welche in
kurzer Zeit genaue Resultate geben und auch in den Händen des reinen Praktikers
zuverlässig seyn sollte.
Die tiefblaue Farbe ammoniakalischer Kupferlösungen schien den geeigneten Weg
anzuzeigen, da die Intensität derselben wesentlich von dem Gehalte an Kupfer
abhängig ist. Elf Reagensgläser von gleichem Durchmesser, nicht zu eng, wurden mit
Flüssigkeiten gefüllt, die dadurch erhalten waren, daß je 5, 6, 7–15
Aequivalente (in Milligrammen, H = 1) Kupfervitriol
aufgelöst, mit Ammoniak übersättigt und bis auf 1 Liter verdünnt wurden. In ein
Gestell nebeneinander gestellt, bildeten sie eine regelmäßige Farbenscala, in welche
man ähnliche Lösungen von unbekanntem Gehalte bequem und sicher einreihen und so
wenigstens zwei Grenzen für den Gehalt bestimmen konnte.
Die Sicherheit dieser Bestimmungen veranlaßte die HHrn. Siemens und Halske zur Construction des
nachfolgend beschriebenen Apparates zur colorimetrischen Analyse, vorläufig nur für
Kupferanalysen bestimmt.
Es ist zu bemerken, daß sich im Handel blaue Gläser fanden, deren Farbenton für
vorliegenden Zweck hinreichend genau mit dem der ammoniakalischen Kupferlösung
übereinstimmte. Hiernach erschien es zweckmäßig, die Farben der Lösungen nicht unter
sich, sondern mit einem bestimmten solchen Glase zu vergleichen, und zwar gestattet
der Apparat:
die Länge derjenigen Flüssigkeitssäule zu messen, welche an Licht absorbirender Kraft
der Normalglasplatte gleich ist.
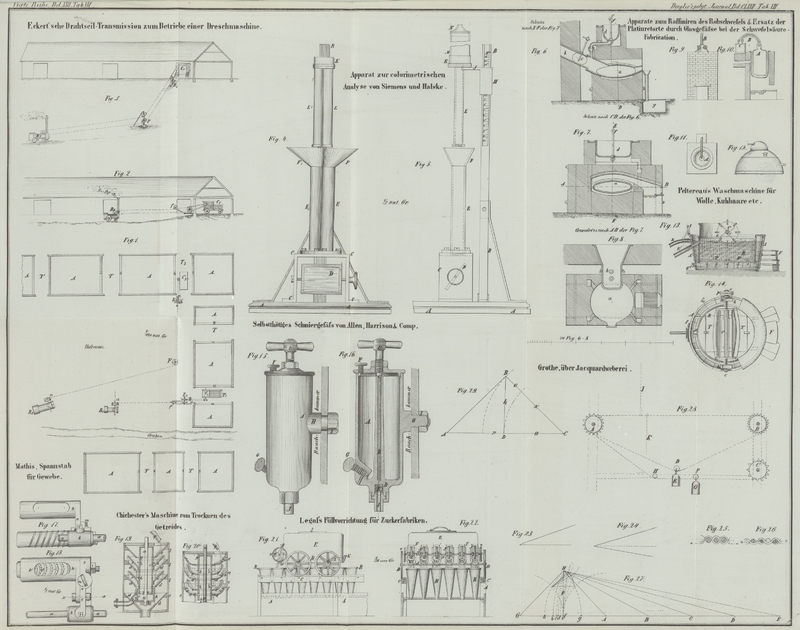
Auf einer hölzernen Bodenplatte A, Fig. 4 und 5, circa 300 Millimeter lang und breit, steht eine vierkantige hölzerne Säule
B circa 320 Millimet. hoch, mittelst Flacheisen von
drei Seiten her senkrecht gehalten. Vor der Säule steht ein förmiges
Messingstück C. Ein innerhalb desselben
befindlicher, um eine horizontale Achse drehbarer Spiegel D wirft das von vorn auffallende Licht nach oben. Die obere horizontale
Platte des Stückes C hat neben einander zwei Löcher zur
Aufnahme zweier Röhren E und E'. Diese sind unten durch plan geschliffene Gläser geschlossen und
mittelst Flantschen und Schrauben auf C befestigt. Sie
sind aus reinem Zinn gegossen und tragen oben angegossen die Trichter F und F'. Mit den Trichtern
sind sie circa 200 Millimeter lang.
An der Säule B entlang läßt sich der Messingschieber H verschieben.
Dieselbe trägt eine Platte J, welche den Boden eines
kurzen Cylinders K bildet und zugleich zwei Löcher hat
zur Aufnahme der beiden Röhren L und L'; diese, ebenfalls von Zinn gegossen, sind in J eingelöthet, oben offen, unten durch plan geschliffene
Gläser verschlossen. Sie stehen mit den Röhren E und E' nahezu conaxial und lassen sich, da sie enger sind
als diese, mit Hülfe des Schiebers in denselben auf und ab bewegen. Sie sind so
lang, daß ihre Gläser gerade auf den Gläsern von E und
E' aufliegen, wenn J auf
den Trichtern F aufliegt. Bei dieser Stellung des
Schiebers schneidet dessen obere Kante gerade mit 0 eine an der Säule angebrachte
Millimeter – Scala ab. In jeder anderen Schieberstellung gibt also die
Ablesung an der oberen Schieberkante direct den Abstand der Glasplatten in
Millimetern an.
In den kurzen Cylinder K wird ein Papprohr M gesetzt, welches oben ein mit einem kleinen Loche
versehenes Messing stück N trägt. Blickt man in dieses
Loch, so kann man gleichzeitig in beide Röhrenpaare sehen.
Ein Stückchen von passendem blauen Glase ist so abgedreht, daß es in die Röhren L hineingeworfen werden kann und unten aufliegend das
ganze Gesichtsfeld einnimmt.
Stellt man den Apparat so gegen das Fenster, daß der Spiegel das Licht nach oben
reflectirt, gießt die Trichter F fast voll Wasser und
F' fast voll mit einer zu prüfenden Flüssigkeit,
wirft sodann in L das blaue Gläschen, so sieht man,
durch N hinabsehend,
wenn der Schieber unten steht: rechts nur durch farblose Gläser,
links durch ein blaues und zwei farblose;
wenn der Schieber oben steht: rechts durch zwei farblose Gläser
eine gefärbte Flüssigkeitssäule, links durch ein blaues und zwei farblose Gläser und
Wasser.
Ist die Flüssigkeit nicht gerade sehr schwach gefärbt, so wird jetzt das Feld rechts
dunkler blau erscheinen als das Feld links, es wird aber beim Hinabstellen des
Schiebers immer Heller werden, während das links sich fast gleich bleibt. Da beide nahe bei einander
liegen, so kann man sehr geringe Lichtunterschiede wahrnehmen und den Schieber so
einstellen, daß beide Felder gleiche Helligkeit zeigen. An der Theilung liest man
dann ohne Weiteres die Länge der Flüssigkeitssäule ab, welche mit dem Glase gleiche
Licht absorbirende Kraft hat.
Um aus den so abgelesenen Längen die Gehalte zu finden, ist nöthig:
1) eine Flüssigkeit von bekanntem Gehalte zu messen;
2) zu ermitteln nach welchem Gesetz die absorbirende Kraft mit dem Gehalte an Kupfer
wächst.
Eine Normalflüssigkeit wurde durch Auflösen von 10 Aequivalenten (in Milligrammen)
Kupfervitriol in Wasser, Uebersättigen mit Ammoniak und Verdünnen auf 1 Liter
hergestellt; dieselbe gab eine Ablesung von 107 Millimetern. Eine große Menge von
anderen Flüssigkeiten, die ungefähr zwischen der Hälfte und dem Vierfachen dieses
Gehaltes hergestellt waren, gaben Ablesungen genau umgekehrt proportional ihren
Kupfergehalten. Erhält man also mit einer Flüssigkeit von unbekanntem Gehalte die
Ablesung 1, so wird im Liter derselben 1070/1 Atome oder 33,92/1 Gramme Kupfer
enthalten seyn.
Die Herstellung der Flüssigkeit zum Messen wird natürlich nach der Beschaffenheit der
Erze eine verschiedene seyn. Bei den Eingangs erwähnten Erzen war die
Zusammensetzung, so weit für Vorstehendes wesentlich, durchschnittlich
in Säuren unlöslich circa
40
Manganoxyde circa
35
Eisenoxyd circa
17
Oxyde von Kupfer, Blei, Kobalt etc. circa
8
––––
zusammen
100
und wurde die Analyse wie folgt ausgeführt:
Die eingeholten Proben wurden numerirt, bezeichnet, bei circa 130° C. getrocknet, gepulvert und gesiebt. Es wurden dann 10
Grm. (bei armen Erzen 20 bis 30 Grm.) abgewogen, in einer Porzellanschale mit circa 100 Kubikcentimetern verdünnter Schwefelsäure (von
10 Proc.) etwa 1/4 Stunde gekocht, die Masse in einen 1/2 Liter Kolben gespült, noch
heiß mit circa 100 Kub. Cent, starker
Ammoniakflüssigkeit übersättigt und unter häufigem Schütteln etwa eine Stunde
digerirt. Der Kolben wurde dann mit Wasser bis zur Marke aufgefüllt, und nach dem
Absetzen ein Theil der Flüssigkeit durch ein Faltenfilter abfiltrirt. Da der Apparat nur circa 60 K. C. faßt, so reicht ein Theil der Flüssigkeit
schon zu mehreren Messungen hin, aus denen man dann das Mittel nimmt. Die ersten
Theile des Filtrats werden nicht benutzt, da sie durch das Wasser des Filters
verdünnt sind. Vor der Messung bleibt die filtrirte Flüssigkeit noch circa 6 Stunden offen stehen.
Hatte man etwa 20 Grm. Substanz auf 1/2 Liter Flüssigkeit gebracht und die Zahl 87
als mittlere Ablesung erhalten, so entspricht diese Ablesung 1070/87 Atome oder
(1070 . 31,5)/87 Milligrm. oder 0,389 Grm. Kupfer im Liter. Dieser Gehalt entspräche
40 Grm. Substanz, es ist also der Procentgehalt 100/40 . 0,389 = 0,97 Proc.
Nach erhaltener Anleitung und kurzer Uebung war der Steiger jener Gruben im Stande
täglich 25 bis 30 Analysen zu vollenden. Die Genauigkeit derselben ließ nichts zu
wünschen übrig. Controlversuche, welche zuweilen auf dem gewöhnlichen analytischen
Wege angestellt wurden, ergaben beispielsweise 0,96 Proc. wo durch Farbenmessung
0,97 Proc., oder 3,51 Proc. wo 3,53 Proc., oder 2,48 Proc. wo 2,50 Procent gefunden
waren. Die Ablesungen mit verschiedenen Portionen der nämlichen Flüssigkeit
unterscheiden sich bei einiger Uebung selten um mehr als 1–1,5
Millimeter.
Wo es sich um die Analyse Schwefelkupfer haltender Erze handelt, man also mit
Königswasser aufschließen muß, wird man auch die Normalflüssigkeit mit Zusatz
desselben herstellen.
Ein Umstand, der leicht zu Fehlern Veranlassung geben kann, liegt in der mehrfach
beobachteten Veränderlichkeit der Farbenstärke der Flüssigkeiten aus noch nicht
studirten Gründen. Allein diese Veränderung erreicht eine Grenze und ihr Einfluß
wurde dadurch eliminirt, daß man zu allen Flüssigkeiten fast gleiche Mengen
Schwefelsäure und Ammoniak nahm und alle vor der Messung 6 Stunden stehen ließ. Nach
dieser Zeit wurde eine Veränderung nicht mehr bemerkt.
Auch zur Ermittelung des Kobaltgehaltes in denselben Erzen
wurde der Apparat benutzt, indem man die Farbenstärke des in Lösung gebrachten
schwefelsauren Salzes mit einem rosa gefärbten Glase verglich. Der Erfolg, zwar für
jene Zwecke ausreichend, war jedoch nicht so günstig wie beim Kupfer. Die geringere
Farbenintensität des Kobaltsalzes läßt bei der Einstellung um mehrere Millimeter in
Zweifel.
Auch das folgende, von Hrn. Prof. Himly in Kiel
vorgeschlagene Verfahren erwies sich beim Kobalt als
anwendbar.
Die Lösungen von Chromchlorid und von schwefelsaurem Kobaltoxyd sind nahezu complementär
gefärbt. Beim Zusammengießen entfärben sie sich gegenseitig und es tritt ein Punkt
ein, wo die Flüssigkeit fast farblos ist. Dieser Punkt hängt nur von den Salzmengen
und nicht von der Verdünnung ab; man kann also mit einer einmal gegen Kobaltlösung
von bekanntem Gehalte titrirten Chromlösung Kobaltlösungen von unbekanntem Gehalte
maaßanalytisch bestimmen.
Leider wird der Punkt genauer Farbencompensation durch eintretende gelbliche Färbung
der Flüssigkeit verdeckt und man bleibt über die zuletzt nöthigen Mengen des Reagens
im Zweifel. Doch genügt die Analyse den Anforderungen der Praxis.
Bei diesem Verfahren kann man sich einer Auflösung von schwefelsaurem Nickeloxydul
etwa mit dem nämlichen Erfolge bedienen wie der Auflösung von Chromchlorid. Zwar ist
erstere Lösung nicht so intensiv gefärbt, man bedarf also größere Mengen, erhält
sehr verdünnte Flüssigkeiten, wodurch die Farben minder entschieden werden. Dagegen
ist das Salz einer Aenderung seines Farbentones nicht unterworfen, was nach Angabe
von Hrn. Himly beim Chromchlorid der Fall ist und wodurch
neue Vorsichtsmaßregeln nöthig werden.
Es ist wahrscheinlich, daß diese Compensationsmethode, angewendet auf den oben
beschriebenen Apparat, auch gute Resultate geben wird. Das Instrument wird
wesentlich einfacher, da anstatt zweier nur ein Röhrenpaar nöthig ist. Man wendet
anstatt eines gleichfarbigen Glases neben nun ein complementär gefärbtes Glas über
der Flüssigkeitssäule an und variirt deren Länge so lange, bis keiner der beiden
Farbentöne vorherrscht.
Tafeln