| Titel: | Ueber die Ablagerung von Kohlenstoff und andern Körpern aus Hohofengasen; von J. Pattinson. |
| Autor: | J. Pattinson |
| Fundstelle: | Band 223, Jahrgang 1877, S. 473 |
| Download: | XML |
Ueber die Ablagerung von Kohlenstoff und andern
Körpern aus Hohofengasen; von J.
Pattinson.
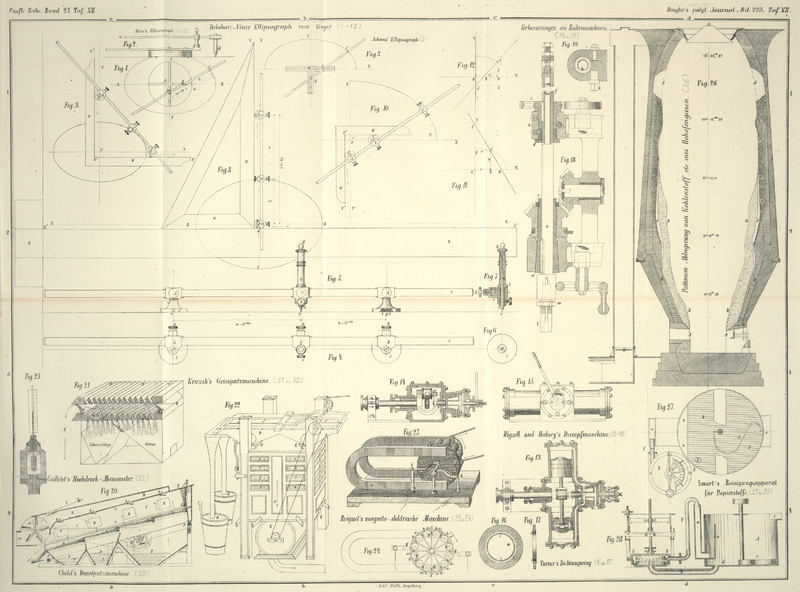
Mit einer Abbildung auf Taf. XII [d/1].
Pattinson, über Ablagerung aus Hohofengasen.
Beim Ausblasen zweier der großen Hohöfen von Gilkes, Wilson,
Peak und Comp. nach einer Campagne von nur 5
Jahren zeigte sich gegen alle Erwartung, daß das innere Mauerwerk bis zur Ofengicht
vollständig zerfressen oder vielmehr zerbröckelt war, und daß nicht nur der Herd und
das Gestell, sondern auch der ganze Ofenschacht vollständig erneuert werden mußte.
John Pattinson, Chemiker in
Newcastle-upon-Tyne, unterzog die zerbröckelten Steine einer genauen
Untersuchung, um die Ursachen der Zerstörung festzustellen und eventuell denselben
vorzubeugen, und veröffentlichte seine Resultate in einer Sitzung des Iron and Steel Institute, welche im Engineering, 1876 Bd. 21 S. 262 ff. abgedruckt sind.
Schon ein bloser Blick auf die zerbröckelten Steine genügte, um festzustellen, daß
dieselben mit einer kohlenstoffhaltigen Substanz imprägnirt waren, und daß grade die
Anhäufung dieser Substanz in den Poren der Steine die Zerstörung derselben
herbeigeführt hatte. Die Steine, in welchen obige Erscheinung am meisten hervortrat,
waren so weich, daß sie leicht mittels irgend eines spitzen Instrumentes durchbohrt
und zwischen den Fingern zu einem feinen Pulver zerrieben werden konnten, wobei die
Finger wie durch Lampenruß geschwärzt wurden. Beim Abtragen des Mauerwerkes wurde
von Tag zu Tag die Zunahme, resp. Abnahme dieses Mauerfraßes notirt, und sind die
Resultate in Figur
26 veranschaulicht.
Die Linien A zeigen das ursprüngliche Profil des
Hofofens, während die Linien B das Ofenprofil nach
erfolgtem Ausblasen darstellen; der punktirte Theil des Mauerwerkes, welcher sich
ungefähr in einer Höhe von 10 bis 20m
oberhalb der Herdsohle erstreckt, zeigt die Stelle, an welcher die Steine mit
Kohlenstoff, der viel Aehnlichkeit mit Lampenruß hatte, vollständig imprägnirt
waren. In dem mit C bezeichneten Theile befand sich eine
weiße, undurchsichtige, porzellanartige, gesinterte Masse, welche sich in einer Höhe
von 6 bis 14m oberhalb der Ofensohle
erstreckte; sie enthielt eine große Menge alkalischer Salze, letztere von
hygroskopischer Beschaffenheit. In D wurden gesinterte,
schwarze, kohlenstoffhaltige Massen, gemischt mit einzelnen Stücken von Kokes,
Kalkstein, Schlacke etc., gefunden. Einzelne Theile davon enthielten bedeutende
Mengen alkalischer Salze.
Sowohl der Boden des Herdes, als auch das Mauerwerk oberhalb desselben bis zu einer
Höhe von 9m war vielfach zerfressen und
auch wohl theilweise verschwunden. Oberhalb dieser Zone war das ursprüngliche
Ofenprofil jedoch ziemlich unversehrt, und nur bei 21m oberhalb des Herdbodens war ein totales
Zerfressen des Schachtmauerwertes durch die mechanische Einwirkung der Ofenchargen
hervorgerufen worden. Bei 18m Schachthöhe
hatte sich das ursprüngliche Ofenprofil um etwa 0m,1 verengt, was um so auffallender ist, als diese Querschnittsverengung
nicht durch eine etwaige Adhäsion fremder Substanzen an dem Schachtmauerwerk bewirkt
wurde, wie man sich an den biosliegenden Steinen überzeugen konnte und eine
Erklärung hierfür nur in einem durch die Einwirkung des Kohlenstoffes
hervorgerufenen Zerspringen und Expandiren der Steine gefunden werden kann.
Die feuerfesten Steine, obgleich aus zwei verschiedenen Quellen bezogen, waren
gleichmäßig durch die Kohlenstoffabsonderung angefressen. Eine Analyse der
unversehrten Theile der Steine ergab:
Nr. I.
Nr. II.
SiO₂
55,70
60,47
Al₂O₃
35,50
31,50
Fe₂O₃
4,00
3,10
CaO
0,37
0,37
MgO
1,21
0,89
K₂O
2,60
2,45
Na₂O
0,45
1,25
–––––
––––––
99,83
100,03.
Die Oefen waren durchwegs mit Cleveland-Eisenstein aus verschiedenen Gruben
beschickt worden, und nur durch eine Arbeitseinstellung der Bergleute war man
gezwungen, während kurzer Zeit in die Gattirung Erz aus Northamptonshire
einzuführen.
Zum Zwecke der Analyse der zerstörten Ofensteine wurden Proben an drei verschiedenen
Stellen des Hohofens E, F und G in Höhen von 11,89, 13,71 und 20m,42 oberhalb der Herdsohle gezogen. Die Probe aus E, welche, wie schon hervorgehoben, eine große Menge Kohlenstoff enthielt,
war vollständig imprägnirt mit einem Salze, welches an einzelnen Stellen in
deutlichen Krystallen hervortrat und sich bei der Analyse als Chlorkalium ergab.
Außerdem zeigte sich an einzelnen Stellen Eisenchlorid und Eisenoxydsulfat. Die
Analyse aus E ergab:
SiO₂
0,50
CaO
0,04
MgO
Spuren
K₂O
0,78
Na₂O
0,20
KCl
6,19
Fe
Spuren
SO₃
„
Wasser
1,03
–––––
In Wasser löslich
8,74
SiO₂
47,60
Al₂O₃
26,47
Fe₂O₃
1,32
CaO
0,06
MgO
0,86
K₂O
7,54
Na₂O
0,76
C
5,97
–––––
Unlöslich in Wasser
90,58
–––––
99,32.
Die Probe aus F (13m,71 oberhalb der Herdsohle) ließ sich wie feiner Sand leicht zwischen den
Fingern zu einem feinen Pulver zerreiben; die schwarze Farbe hatte einen Stich ins Graue, und
gewährte das Ganze das Aussehen von schwarzen Kokes. Auch war die äußere Fläche des
Probestückes mit Salzen durchsetzt, welche an dieser Stelle den sonst leicht
zerbröcklichen Stein etwas zusammenhielten. Zur Analyse gelangte nur der leicht
zerbröckliche Theil. Die Probe aus G (20m,42 oberhalb der Herdsohle), dem höchsten
Ofenniveau, in welchem noch eine tiefere Zerstörung stattgefunden, konnte nicht
zwischen den Fingern zerbröckelt werden, obgleich durch die Einwirkung der
Kohlenstoffablagerung ein theilweises Anfressen und Zerbersten der Steine
eingetreten war. Die beiden Probestücke aus F und G hatten folgende Zusammensetzung:
Stein aus F.
Stein aus G.
SiO₂
55,67
55,60
Al₂O₃
30,00
35,40
Fe₂O₃
3,00
2,67
CaO
0,23
0,34
MgO
0,95
1,22
K₂O
5,30
2,10
Na₂O
1,67
0,42
Cl
0,04
–
C
3,14
2,05
–––––––––
–––––––––
100,10
99,80.
Vergleicht man die drei letzten Analysen mit derjenigen der Originalsteine, so ergibt
sich außer einer Zunahme von Kohlenstoff noch ein beträchtlicher Zuwachs von Kali.
Die Ursache dieser Kohlenstoffablagerung findet leicht ihre Erklärung in dem
Verhalten des Kohlenoxyds zu Eisenoxyd. Ausführliche Versuche von J. L. Bell haben zur Genüge dargethan, daß bei einer
Temperatur, welche zwischen 200° und der Rothglühhitze liegt, das in den
Hohofengasen enthaltene Kohlenoxyd sich unter Absonderung von Kohlenstoff zu
Kohlensäure zerlegt, wenn die Gase mit Eisenoxyd zusammen kommen. In dem
vorliegenden Falle sind nun alle Bedingungen erfüllt, die zum Eintreten dieser
Reaction erforderlich sind; die Analyse der Originalsteine ergab einen Gehalt an
Fe₂O₃ von 3,10 bis 4,00 Proc., die Structur der Steine ist eine poröse
und daher zum Durchlassen von Gas sehr geeignet, und die nöthige Temperatur ist
ebenfalls vorhanden gewesen.
In einem seiner Versuche über die Dissociation des Kohlenoxyds setzte J. L. Bell der Einwirkung dieses Gases gebrannten Bimsstein
aus, welcher vor dem Brennen mit einer Eisenvitriollösung getränkt worden war. Es
befand sich also dieser so präparirte Bimsstein in einem ähnlichen Falle wie die
Hohofensteine, da beide Substanzen aus erdigen Silicaten bestanden, zwischen welchen freie
Eisenoxydtheilchen eingesprengt waren, obwohl der Gehalt an Eisenoxyd des
Bimssteines wahrscheinlich ein etwas größerer war als derjenige der feuerfesten
Steine. Nach einer 9stündigen Einwirkung des Kohlenoxydes hatten sich auf 100 Th.
Eisen des Bimssteines 770 Th. Kohlenstoff ausgeschieden. Analog hatte sich z.B. in
dem Ofensteine der Zone E auf 100 Eisen 581 Th.
Kohlenstoff abgesondert.
Eine sorgfältige Untersuchung der Steine zeigte, daß in denselben eine Anzahl von
Eisenflecken vorhanden waren, welche von Eisenstein- oder Pyritstücken
herrührten, die sich in dem Thone vorfanden, und grade in diesen Eisenflecken wurde
der größte Theil von abgesondertem Kohlenstoff vorgefunden. An den solchen
Eisenflecken correspondirenden Stellen wurden kleine Nester von eisenschüssigem
Kohlenstoff sichtbar, deren Größe oft die einer Pferdebohne erreichte. Auch war die
Kohlenstoffablagerung an einzelnen Stellen oft eine so große, daß der Stein
aufbrechen mußte und dann den Gasen einen um so leichtern Zutritt gewährte. Einzelne
Steine zeigten Kohlenstoffabsonderungen nur an solchen Stellen, während andere, bei
welchen die Einwirkung eine vollständigere war, mit Kohlenstoff völlig durchsetzt zu
sein schienen, und war das Ganze zu einer zerbröckelten Masse umgewandelt worden.
Die Analyse der kohlenstoffhaltigen Masse an den Eisenflecken ergab:
Kohlenstoff
84,9
Asche (hauptsächlich Fe₂O₃)
15,1
–––––
100,0.
Zum Zwecke der Ausführung einer genauen Analyse wurden größere Mengen solcher
Kohlenstoffablagerungen zu erhalten versucht; jedoch enthielt die Probe, wie sich
aus folgender Analyse ergibt, eine größere Menge zerbröckelter
Ziegelsteinstückchen:
C
57,76
Fe
3,08
SiO₂
19,65
Al₂O₃
12,00
CaO
0,28
MgO
0,51
K₂O
2,43
Na₂O
0,63
SO₃
Spuren
S
0,44
Feuchtigkeit
2,60
––––––
99,38.
Es wirft sich nun die Frage auf, warum obige Erscheinungen nicht auch bei andern
Hohöfen bemerkt wurden; sicherlich haben sie in den meisten Fällen keine Beachtung
gefunden, und werden nach vollendeter Campagne die meisten Oefen ohne irgend welche
Rücksichtnahme abgetragen, obgleich ohne Zweifel in vielen Fällen eine theilweise
Zerstörung der Steine auftritt. So war das Mauerwerk eines Canals, welcher um die
Gicht eines Hohofens in Lincolnshire lief und zur Abführung der Gichtgase diente,
durch eine Absorption von Kohlenstoff vollständig zerstört, und auch Thomas, Betriebsführer der Tudhoer Hohöfen, constatirte
eine vollständige derartige Zerstörung der Ofensteine bis zu einer Höhe von 11 bis
12m unterhalb der Ofengicht. Auch ist
wahrscheinlich die Ursache des Zerspringens der eisernen Ofenarmatur in vielen
Fällen in einer solchen Einwirkung des Kohlenstoffes auf das Ofenmauerwerk zu
suchen, wie ein solcher Fall auch durch Howson auf der
Hütte von Samuelson in Middlesborough constatirt wurde,
wo sich in den zerstörten Steinen außer Kohlenstoff noch bedeutende Mengen von
Zinkoxydkrystallen abgelagert hatten.
Ohne Zweifel tritt jedoch obige Erscheinung nicht bei allen Hohöfen ein. Auch müssen
noch andere Ursachen als die eben angedeuteten einwirken, um eine solche
Kohlenstoffablagerung zu veranlassen, wie dies nachgewiesen wurde beim Ausblasen
anderer Hohöfen der nämlichen Firma, zu welchen dasselbe Ofenbaumaterial verwendet
wurde. Die Ursache eines solchen verschiedenen Verhaltens mag schon durch die
Verschiedenheit der Ofenhöhen bedingt werden, da bei den neuern hohen Oefen die Gase
einen größern Druck im Ofenschacht zu überwinden haben und folglich auch um so
leichter in die Poren der Ofensteine eindringen. Auch ist die Stückgröße der Erze
von wesentlichem Einflusse, und bei einer Beschickung von verhältnißmäßig kleinern
Erzstücken, z.B. von Erzen aus Northamptonshire, ist die von den Gasen im Ofen zu
überwindende Pressung eine relativ größere.
Bei Auswahl von Hohofensteinen dürften nach Obigem folgende Anhaltspunkte maßgebend
sein:
1) muß der Eisenoxydgehalt derselben ein möglichst geringer sein;
2) dürfen die Steine keine Eisenflecken enthalten;
3) ist eine möglichst dichte Structur derselben sehr vortheilhaft, da letztere dem
Eindringen der Gase in dieselben widersteht.
In Bezug auf die andern von den Steinen absorbirten Körpern ist der große Gehalt an
Kali auffallend. Während in einer Höhe von 8m,82 über der Herdsohle 11,45 Proc. Kali nachgewiesen werden, also mehr
als das vierfache des ursprünglichen Gehaltes (2,45 Proc.), sinkt dieser Gehalt bei
13m,71 Höhe auf 5,30 Proc., und ist bei
20m,42 Höhe der ursprüngliche Gehalt an Kali
dieser Steine unverändert, so daß also schon in dieser Höhe eine Ablagerung von Kali
nicht mehr eintritt. Träger dieses Kalis sind ebenfalls die Gase. Die Untersuchungen
von Bell haben einen bedeutenden Gehalt an Alkalien in
den Gasen der untern Ofentheile nachgewiesen; letztere häufen sich allmälig aus den
in der Beschickung enthaltenen geringen Mengen. Es verflüchtigen sich nämlich bei
der intensiven Hitze in der Nähe der Formen die alkalischen Salze und bewegen sich
mit den Ofengasen nach aufwärts, um dann in höhern Ofentheilen, wo sie sich an den
zu durchdringenden Ofengichten bedeutend abkühlen, wieder zu condensiren, auf diese
Weise mit der Beschickung niederzugehen und sich abermals in der Nähe der Formen zu
verflüchtigen. Hat sich auf diese Weise eine gewisse Menge angesammelt, so entfernt
sich der Ueberschuß entweder mit der Schlacke oder mit den Ofengasen.
Es ist einigermaßen auffallend, daß in den Steinen bei E
ungefähr 4 Proc. Kalium als Chlorid vorhanden ist, während es in Verbindung mit
Kohlensäure nicht vorkommt. So sind nach Bell 52,9 Proc.
Chlorammonium in einer Substanz vorhanden, welche in der Gasleitung eines mit rohem
Cleveland-Eisenstein beschickten Hohofens gefunden wurde, während in den
Gasen 0,57 Proc. Chlor nachgewiesen wurden. In dem betreffenden Steine aus der Zone
E waren einzelne vollständig ausgebildete Krystalle
von Chlorkalium vorhanden. Es ist allgemein bekannt, daß der Gehalt an
Chlormagnesium in einzelnen Erzsorten des Clevelands zuweilen sehr bedeutend ist,
und es ist deshalb anzunehmen, daß durch die Einwirkung der Ofenhitze diese
Verbindung sich zerlegte und das auf diese Weise frei gewordene Chlor sich mit dem
Kalium zu Chlorkalium verband, um später seinen Weg in die Ofensteine zu finden. Die
Auflösung von Eisen in demselben Material ist einfach das Resultat der Einwirkung
des Kaliumchlorids und anderer Chloride bei Gegenwart. von Wasser auf die kleinen
Eisentheilchen, nachdem das Probestückchen aus dem Ofen entfernt war. Die Bildung
von Rost beim Mischen von Eisenfeilspänen mit Salmiak oder gewöhnlichem Kochsalz ist
ja eine allgemein bekannte Erscheinung, und in diesem so gebildeten Roste ist immer
lösliches Eisen vorhanden.
Die porzellanartige Masse, welche bei einer Höhe von 6 bis 14m sich an einzelnen Stellen bis zu 0m,23 aufgelagert hatte, zeigte sich in der
Luft von sehr hygroskopischer Beschaffenheit; an einzelnen Stellen war sie etwas
grünlich gefärbt. Die Zusammensetzung derselben war folgende:
SiO₂
37,07
Al₂O₃
23,18
K₂O
21,59
Na₂O
6,28
CO₂
2,17
CaO
0,17
MgO
–
Fe₂O₃
0,96
H₂ O
7,70
–––––
99,12,
also hauptsächlich ein Gemenge von Aluminium-,
Kalium- und Natrium-Silicaten mit etwas kohlensauren Alkalien und
andern Körpern.
Man könnte bei näherer Betrachtung der Analyse vielleicht den Schluß ziehen, daß
durch die Einwirkung der mit Alkalien geschwängerten Gase auf die Ofensteine sich
eine gesinterte Masse gebildet habe, welche an den Ofenwänden entlang bis zu ihrer
augenblicklichen Lage geflossen wäre. Aber ein Blick auf die Ofenskizze in Figur 26 zeigt
zur Genüge, daß der Ofen nicht allein hinter seiner Ablagerung, sondern auch
oberhalb derselben unverändert geblieben ist, mit Ausnahme bei einer Höhe von
ungefähr 15m,30, wo jedoch die entfernten
Steintheile so gering sind, daß sie unmöglich die bedeutende Ablagerung erklären
können. Desgleichen können die aufgegebenen Gichten in diesem Ofentheile nicht
geschmolzen worden sein, da sonst größere Mengen Kalk und Magnesia sich nachweisen
lassen müßten. Die Bildung dieser Substanz erfolgte sehr wahrscheinlich durch die
Condensation an den Ofenwänden von Kieselsäure, Thonerde, Kali und andern Körpern,
welche an den Formen verflüchtigt und mit den Gasen nach oben geführt wurden. In
einer analogen Weise lagerte sich zweifelsohne die schwarze Masse in D ab. Die Analyse derselben ergab:
SiO₂
33,60
Al₂O₃
21,46
K₂O
24,27
Na₂O
4,51
CN
Spuren
CO₂
2,33
CaO
0,97
MgO
0,76
Fe₂O₃
1,65
SO₃
0,14
S
0,16
C
6,87
H₂O
2,90
–––––
99,42.
Wie vorhin so finden wir auch hier ein Gemenge von Thonerde-, Kali- und
Natronsilicaten mit einigen Alkalicarbonaten und andern Körpern, unter welchen der
Kohlenstoffgehalt bis 7 Proc. beträgt und die Masse schwärzt. Dieser Kohlenstoff ist
äußerst fein zertheilt und wahrscheinlich das Product der Dissociation von
Kohlenoxyd.
Mit Recht muß man sich wundern über die Widerstandsfähigkeit der Ofensteine gegen die
zerstörenden Einflüsse, welchen sie ausgesetzt sind. Immerhin jedoch ist es höchst
wahrscheinlich, daß die Ablagerung von solchen Substanzen wie die oben angegebenen
wohl wenig zur Erhaltung der Ofensteine beiträgt, indem sie den Gasen den Zutritt zu
den Steinen verwehrt. Auch zeigte sich erst bei einer Höhe von 11m oberhalb des Herdes die zerbröckelnde
Einwirkung des Kohlenstoffes auf die Steine, während unterhalb dieser Höhe die
Steine durch die schützende Decke der Aluminium- und Alkalisilicate
vollständig unversehrt blieben.
P. M.
Tafeln