| Titel: | J. Hollway's Schmelzprocess für Schwefelmetalle bei beschleunigter Oxydation und ohne Anwendung von Brennmaterial; von F. Bode, Civilingenieur in Hannover. |
| Autor: | F. Bode |
| Fundstelle: | Band 232, Jahrgang 1879, S. 433 |
| Download: | XML |
J. Hollway's Schmelzproceſs für Schwefelmetalle
bei beschleunigter Oxydation und ohne Anwendung von Brennmaterial; von F. Bode,
Civilingenieur in Hannover.
Mit einer Abbildung auf Tafel 38.
Bode, über Hollway's Schmelzproceſs für
Schwefelmetalle.
Am 12. Februar 1879 legte Hollway der Society of Arts in London eine interessante Schrift
vor, welche über im groſsen Maſsstabe ausgeführte Versuche berichtet, das Kupfer aus
kupferarmen Schwefelkiesen auf trockenem Wege, aber ohne Anwendung von Schmelzkohle,
zu gewinnen, mindestens
so weit zu concentriren, daſs das Product im Stande ist, eine namhaftere Fracht zu
ertragen, so daſs es in üblicher Weise auf trockenem Wege in Hütten weiter
ausgebracht werden kann, welchen billige Kohlen zur Verfügung stehen. Hollway denkt hierbei in erster Linie an die spanischen
kupferhaltigen Schwefelkiese, welche mit höchstens 4 Proc. Kupfer in England fast
allgemein zur Schwefelsäurefabrikation benutzt und deren Abbrände dann, meist in
besonderen Werken, nach Hendersons Verfahren (1879 231 259) auf nassem Wege entkupfert (auch entsilbert und
entgoldet) werden. Spanische Riotinto-Kiese verarbeitet man auch in Deutschland, wo
sie mit (garantirt) 48 Proc. Schwefel zum Absatz kommen.
Der Reichthum schon allein der spanischen und portugiesischen Gruben an solchem
kupferhaltigen Schwefelkies ist ein ungeheurer. Im südlichen Spanien fordern allein
die Riotinto Company, die Tharsis Company und die Firma Mason und Barry
jährlich 1½ bis 2 Millionen Tonnen Kiese und beträgt die englische Einfuhr jährlich
über 610000t. Aehnliche groſse Lagerstätten mit
mäſsigem Gehalt an Kupfer gibt es in den Karpathen, in Siebenbürgen, Südamerika,
Cuba, Australien, am Cap der guten Hoffnung und gewiſs noch an manchen anderen
Plätzen, wo man wegen theuren Brennmaterials dem Kupfer mittels des gewöhnlichen
Verschmelzens nicht beikommen kann und wo man sich des primitivsten nassen Processes
mit groſsen Kupferverlusten, der Cementation, bedienen muſs.
Trotz ihres Reichthumes ist aber die Ausbeutung dieser Lagerstätten doch eine
beschränkte. Am günstigsten sind noch diejenigen gestellt, welche, wie die
spanischen, eine groſsartig entwickelte chemische Industrie mit Schwefel zu
versorgen in der Lage sind. Aber auch hier findet die Erzförderung bald eine Grenze
an diesem Schwefelbedarf selbst. Wo ein solcher fehlt, da ruht die Erzgewinnung
gänzlich oder beschränkt sich auf ein Minimum für die Cementkupfer-Gewinnung, welche
mit Preisgebung des sämmtlichen Schwefels erfolgt. Nur ausnahmsweise werden geringe
Antheile des letzteren gewonnen (vgl. 1879 231 255).
Die ärmeren und Abfall-Erze mit 1,5 Proc. Kupfer und weniger werden an den spanischen
Gruben durch Röstung und Auslaugung auf Kupfer verarbeitet; man bringt hierbei (nach
der mir vorliegenden Quelle) 85 Proc. des Kupfers aus, nämlich etwa 65 Proc. direct
durch Auslaugen in Gefäſsen und später noch 20 Proc. aus den gelaugten Rückständen.
Die Kosten betragen für 100t behandeltes Erz
1329,10 M., und da man hieraus nur 1t,275 Kupfer
(= 85 Proc.) auszieht, für welches man 1,181 M. auf 1k zu setzen hat, so ist von 100t Erz die
Bruttoeinnahme 1505,77 M. und mithin der Bruttogewinn 176,76 M. Bei einem 2 proc.
Erz würden zwar die Auslagen auf 1525,50 M. steigen, dagegen der Gewinn sich auf
451,10 M. erhöhen.
Dieses Verfahren ist aber mit schweren Nachtheilen, auch abgesehen von dem
Kupferverluste, behaftet. Mehrere Monate jährlich müssen die Werke wegen
Wassermangel still liegen; wenn alsdann der Regen kommt, so fällt er in groſser
Menge und führt erhebliche Kupferverluste herbei. Ferner verderben sowohl die
Röstgase meilenweit die Vegetation, wie die flüssigen Abgänge die Gewässer derart,
daſs Behörden und Bevölkerung sich dieser Industrie gebenüber stets feindselig
verhalten und die spanische Regierung sie auf die bestehenden Plätze eingeengt hat
(in Portugal ist sie sogar untersagt worden). Auch ist das Verfahren nur für arme
Erze unter 3 Proc. Kupfer brauchbar und endlich gehen Schwefel, Silber und Gold
gänzlich verloren.
Die Hitze, welche solche Schwefelkiese bei ihrer Verbrennung zu liefern vermögen, ist
bisher nur in der Weise benutzt worden, um Rostprocesse damit weiter zu führen, wie
solche der Cementation in freien Haufen vorausgehen oder in den
Schwefelsäurefabriken in Oefen gehandhabt oder auf Hüttenwerken als Vorbereitung
eines Schmelzprocesses ausgeübt werden. Dagegen beschränken sich die Bestrebungen,
die Verbrennungswärme dieser Materialien zu Schmelzungen der Masse selbst nützlich
zu verwenden, nur auf Versuche, und die von Hollway
mitgetheilten scheinen mir immerhin der Beachtung werth, wenn ich auch bemerken
muſs, daſs er mehrfach spielend über Schwierigkeiten hinweggeht, welche erst recht
auftauchen werden, wenn die mit den bisherigen Versuchen erlangten Resultate zu
einem regelrechten und ununterbrochen gehenden Verfahren ausgebaut werden
sollen.
Hollway drückt stark gepreſsten Wind in die
geschmolzenen Massen der zu behandelnden Schwefelmetalle – ebenso wie Bessemer durch das Eisenbad in der Bessemerbirne, wie
denn auch die Versuche mit einem Bessemerapparat angestellt sind – und erzielt
hierdurch einen energischen Verbrauch an Sauerstoff (welcher beim Durchgange durch
das Bad vollständig verzehrt wird), in Folge davon eine
zur Unterhaltung der Operation hinreichende Temperatur und eine Abkürzung der
Zeitdauer der Schmelzungen selbst. Hollway ist nicht
der Erste, der ein solches Verfahren versuchte, sondern meines Wissens nur der
Erste, der es für Erze direct zur Anwendung bringen will. Es ist darauf aufmerksam
zu machen, daſs man schon früher ganz nach dem Princip von Bessemer und auch in der Bessemerbirne versucht hat, Kupfersteine zu
concentriren, für welchen Zweck (Entfernung eines Theiles Schwefel durch
Verflüchtigung und eines Theiles Eisen durch Verschlackung) man bisher Flammöfen
verwendete.Im J. 1868 berichtete Kupeluieser (1869 191 38) nach Mittheilung von Jossa über die zu Wotkins am Ural stattgehabten
Versuche, einen Kupferstein in einer kleinen Versuchsbirne, passend zur
Aufnahme von 2t Roheisen, zu concentriren.
Diese Versuche haben ein im Ganzen genommen nicht ungünstiges Resultat
ergeben. Man erzielte einen reichen Concentrationsstein und Schlacken von
34,46, 29,46 und 27,20 Proc. Kieselsäure mit Gehalten an Kupferoxyd von
bezieh. 2,13, 8,46 und 8,53 Proc. Da die Analysen aber auch 0,11, 1,68
bezieh. 1,77 Proc. Schwefel aufweisen, so darf man vielleicht annehmen, daſs
ein Theil des Kupfers als Stein der Schlacke beigemengt war.Kupelwieser berechnet die Gewichte der Anfangs-
und Schluſsproducte derart, daſs 1310k,4
Kupferstein 433k,3 concentrirten Stein und
1128k,7 Schlacke lieferten und meint,
daſs etwa 20 Minuten Zeit für den Proceſs nöthig gewesen sein möchten.
Weshalb man auf diesen Versuchsresultaten nicht weiter gebaut hat, darüber
ist nichts bekannt geworden. Anzunehmen ist, daſs das Verfrischen von
Kupferstein in der Bessemerbirne – oder auf einem ähnlichen Wege – nur auf
groſsen Werken ausgeführt werden kann.Auch von Tessié du Motay wurde Einleiten von
Gebläseluft in die geschmolzenen Erze behufs Beschleunigung der Oxydation
und Verminderung der Operationen vorgeschlagen (vgl. Muspratt's Chemie, 3. Auflage Bd. 4 S. 67).
Nachdem Hollway verschiedene Versuche in einfachen
Tiegeln angestellt hatte, ging er seit Juli 1878 zu Versuchen mit einer
Bessemerbirne über, welche, mit dem in England üblichen „Ganister“
ausgefüttert, im Stande war, etwa 6100k Roheisen
auf ein Mal aufzunehmen und mit kaltem Winde versehen wurde. Auſserdem stand zur
Verfügung ein gewöhnlicher Cupolofen, von 1m,22
Durchmesser in der Düsengegend und 1m,525 weiter
oben, mit 8 Düsen, wovon drei mit 76mm und fünf
mit 112mm Oeffnung.Die beiden Luftcylinder der Gebläsemaschine hatten je 1067mm Durchmesser und 1m,22 Hub und machten bei durchschnittlich
5k,1 Dampfdruck auf 1qc im Kessel 45 Umgänge in der
Minute. Die kupferhaltigen Kiese wurden mit Kokes im Cupolofen wie
Roheisen niedergeschmolzen und das erhaltene Monosulfuret gelangte beim Stechen in
die Bessemerbirne. Der Cupolofen ging hierbei mit heller, leuchtender Flamme, deren
Färbung beständigwechselnd war. Der gröſste Theil des Bleies wurde während dieses
Einschmelzens verflüchtigt. Das Spectrum der Gichtflamme zeigte Blei, Natrium,
Lithium und Thallium; Schwefel, Kohlenoxyd und arsenige Säure gaben keine bestimmten
Linien im Spectralapparat. Die Kiese brauchten längere Zeit zum Schmelzen, als eine
entsprechende Menge Roheisen; der erblasene RohsteinSo will ich im Folgenden das im Cupolofen erhaltene Monosulfuret nennen, den
in der Birne erblasenen Stein dagegen Concentrationsstein.
bildete aber eine bewegliche, leicht flüssige Masse.
1. Vorversuch, 10/11. Juli 1878. Etwa 5t,08 Rohstein wurden ½ Stunde lang ebenso geblasen
wie eine Bessemercharge und ohne irgend einen Zuschlag an Fluſsmitteln. Der Inhalt,
aus concentrirtem Stein und Schlacke bestehend, wurde aus der Birne gekippt und
zeigte sich leicht flüssig. Die Schlacke gab beim Abkühlen schöne Krystalle von
Eisenoydulsingulosilicat.Der Fayalith des Mineralreichs (2FeO,SiO2)
krystallisirt im rhombischen System. Die Ganisterfütterung wnr
energisch angegriffen.Durch Entnahme von Kieselsäure zur Schlackenbildung. Ganister ist gemahlener
Sandstein der Kohlenformation, wie er bei Sheffield vorkommt, und enthält
etwa 93 Proc. Kieselsäure, 4 Proc. Thonerde, 1 bis 2 Proc. Eisenoxyd und
Carbonate von Kali, Natron und Kalk. Das Mehl wird angemengt mit wenig
feuerfestem Thon. (Wedding: Eisenhüttenkunde,
Bd. 3 S. 346.)
2. Vorversuch, 11/12. Juli. Der mit etwa 3,4 Proc. Kupfer in die
Birne eingelassene Rohstein gab nach 15 Minuten Blasen einen Concentrationsstein mit
46 Proc. Kupfer. Man hatte in die Birne Sand eingeworfen und zeigte sich der Angriff
des Futters bedeutend ermäſsigt.
Versuche 1 bis 6, 17/18. Juli. Die angewendeten Kiese enthielten 2
bis 3 Proc. Kupfer und in 1000k an Silber 45g,9, sowie an Gold 0g,191. Da man nur mit kleinen Mengen arbeitete, so muſste man sehr
vorsichtig sein, um die Chargen nicht zu überblasen. Man machte gleichzeitig
spectroskopische Beobachtungen und hatte für jeden Versuch die Zeitdauer des Blasens
vorher festgestellt. Nachdem so die Versuche 1 bis 3 ohne Anstand beendet waren (nur
daſs die Steine nicht so concentrirt fielen), wurde beim vierten Versuche
absichtlich ein Ueberblasen herbeigeführt, um den Wechsel im Spectrum zu beobachten.
Danach wurde dann beim 5. und 6. Versuche das Blasen im Augenblicke des
Verschwindens gewisser Linien des Spectrums eingestellt.
Mit einem (elektrischen) Siemens'schen Pyrometer wurde die Temperatur der Gase an der
Birnenöffnung gemessen. Das Pyrometerrohr war an dem der Hitze ausgesetzten Ende auf
etwa 45cm durch ein Porzellanrohr, dann weitere
62cm durch umgeschlagenen Lehm geschützt. Die
erhaltenen Temperaturen sind wegen Verzögerung der Wärmeübertragung mithin zu
niedrig.
Gasproben wurden oberhalb der Birnenöffnung., wo eine Thonglocke aufgehängt war,
durch einen sehr kräftigen Aspirator abgesaugt, der mit der Glocke durch ein mit
Thon umschlagenes eisernes Rohr in Verbindung stand. An den aus der Birne
aufsteigenden, in den Gasen vertheilten sublimirten Substanzen konnte man erkennen,
daſs 3 Secunden nach Beginn des Saugens bereits die Gase in dem Apparate ankamen.
Leider sind aber nur 2 Gasanalysen mitgetheilt, die allerdings dafür sprechen, daſs
ein vollkommener Verbrauch des Luftsauerstoffes stattfindet. Mehr solcher Analysen,
ausgedehnt über die Dauer einer Operation, würden ein vorzügliches Bild der
chemischen Vorgänge liefern und hätten um so leichter angestellt werden können, als
die Untersuchung nicht an Ort und Stelle während der Operation erfolgte, die Proben
vielmehr später im vollständig eingerichteten Laboratorium untersucht wurden.
Wenn die Birne gekippt wurde, so nahm man in der Grube den Geruch nach schwefliger
Säure wahr; bei aufrechter Stellung des Gefäſses aber war während des Blasens keine
schweflige Säure selbst in nächster Nähe der Flamme zu bemerken. Die Ausfütterung
der Birne hatte während der 6 Versuche nicht erheblich gelitten, so daſs ein bereit
stehender Reserveapparat nicht zur Benutzung zu kommen brauchte. Die Flamme der
Birne zeigte im Spectroskop Linien des Natriums, Lithiums und Thalliums, auſserdem
aber vorwiegend Linien unbekannten Ursprunges, von denen einige als Leitlinien für
die Führung des Processes benutzt werden konnten. Bleilinien waren nicht zu
bemerken, ebenso wenig solche des Kupfers, ausgenommen beim vierten Versuche, wo die
Charge 6 Minuten lang überblasen wurde. Das Halbschwefelkupfer gelangte hierbei
nicht sobald zur Oxydation, als, etwa eine Minute lang, die Flamme prachtvoll
meergrün aus dem Maule der Birne strömte und im Spectralapparat alle Linien, mit
Ausschluſs derjenigen
des Kupfers und des Natriums, verschwanden. Dann blieb während der letzten 5 Minuten
das Maul dunkel und ohne Flamme.
Die spezifischen Gewichte des Concentrationssteines und der Schlacken schwankten
nicht erheblich; man fand:
Bei Versuch
1
2
3
4
5
6
Mittel
Für
den Stein
4,73
4,80
5,12
–
5,18
4,95
4,96
„
die Schlacke
4,08
4,10
4,02
3,57
4,20
4,17
4,11Wenn die Zahl unter 4 nicht mit einbezogen wird.
SiO2
29,90
30,05
29,55
–
28,53
26,22
28,85.
Die Zahlen der dritten Reihe geben den Kieselsäuregehalt der Schlacken in Procenten
an. Die Zusammensetzung nähert sich dem Singulosilicat (2FeO,SiO2), welches 29,4 Proc. Kieselsäure enthält. Das hohe
specifische Gewicht dieser Schlacken erschwert die gute Trennung des Steines. Die
concentrirten Steine zeigen meist Ueberschuſs an Eisen, wenn man den Schwefel auf
Halbschwefelkupfer und Einfach-Schwefeleisen berechnet. Sie gaben mit Schwefelsäure
behandelt WasserstoffEs ist nicht ganz deutlich erkennbar, ob die Wasserstoffentwicklung von sämmtlichen Steinen gelten soll. und
Schwefelwasserstoff aus, während Schwefelkupfer unlöslich blieb. Man darf wohl
annehmen, daſs das auf Zusatz von Säuren Wasserstoff entwickelnde Eisen energisch
reducirend auf etwa verschlacktes Kupferoxyd einwirkt und vielleicht erklärt sich in
dieser Weise das beobachtete Auftreten von Haarkupfer im Stein.
Es sind nun noch die Einzelnheiten dieser sechs Versuche anzuführen.
1. Versuch. Das Blasen dauerte 17 Minuten, während welcher Zeit rund 710k Sand in die Birne geworfen wurden. Die Menge des
eingeführten Steines lieſs sich nicht hinreichend genau bestimmen. Der mittlere
Winddruck war 1k,4 auf 1qc. Bei Beginn des Blasens entstiegen der
Birnenöffnung dichte Dämpfe von verschiedener Färbung, die ein Spectrum mit einer
groſsen Zahl heller Linien gaben. Bei Zunahme der Temperatur und nach der
Verflüchtigung des Bleies erschien die Flamme weniger dicht. Das erblasene, in
Eingüssen abgekühlte Product bestand aus drei Zonen: oben Schlacke, in der Mitte ein
Gemisch von Schlacke und Stein, unten Stein. Wir stellen sogleich die Analysen von
den Versuchen 1 und 2 zusammen:
Rohstein
Concentrirter Stein
1
2
1
2
Fe
59,62
60,30
57,10
56,05
Cu
3,52
3,25
15,85
16,59
Zn
1,52
1,88
0,84
0,48
Pb
0,79
0,81
0,22
0,31
As
0,06
0,05
0,04
0,03
Mn
0,21
0,20
0,22
0,20
Al2O3
0,15
Spur
0,11
0,13
CaO
0,28
0,34
0,34
0,16
MgO
0,27
0,32
0,34
0,25
S
33,10
32,50
21,96
23,47
SiO2
0,15
0,30
2,00
1,10
O und Verlust
–
–
0,98
1,23
––––––––––––
––––––––––––––––
99,67
99,95
100,00
100,00.
Schlacke
1
2
Eisenoxydul
53,30
54,62
Eisenoxyd
3,00
3,71
Eisen,
an
Schwefel
gebunden
5,79
4,27
Kupfer,
„
„
„
0,16
0,22
Blei
0,12
0,10
Zinkoxyd
1,15
1,75
Arsen
Spur
Spur
Manganoxyd
0,32
0,37
Thonerde
2,15
2,06
Kalk
0,40
0,37
Magnesia
0,46
0,45
Schwefel
3,39
2,55
Kieselsäure
29,90
30,05
––––––
–––––––
100,14
100,52.
Gemenge von Stein und Schlacke
1
2
Eisen
55,00
58,50
Kupfer
5,00
5,32
Schwefel
10,41
16,47
Kieselsäure
12,70
6,80
–––––
––––––
83,11
87,09.
Durch Kupellation fand man in den concentrirten Steinen des 1.
und 2. Versuches:
g
g
Silber in 1000k
333,274
bezieh.
360,357
Gold in 1000k
9,951
„
10,717.
Drei Kupellationen von je einer anderen Probe gaben im Stein
des 1. und 2. Versuches:
g
g
Silber
in
1000k
276,929
bezieh.
369,983
„
„
„
271,322
„
359,974
„
„
„
274,447
„
364,950
Gold
in
1000k
2,998
„
9,951
„
„
„
2,998
„
9,951
„
„
„
2,998
„
9,951.
Die Temperaturzunahmen während der Versuche sind aus den folgenden Aufzeichnungen zu
ersehen:
1. Versuch
2. Versuch
12 Uhr
19
Min.
68°
(Zunahme)
2 Uhr
11
Min.
60°
(Zunahme)
20
„
157
+ 89°
13
„
85
+ 25°
22
„
169
+ 12
14
„
97
+ 12
23
„
219
+ 50
15
„
168
+ 71
24
„
232
+ 13
17
„
205
+ 37
26
„
292
+ 60
18
„
262
+ 57
28
„
401
+109
19
„
340
+ 78
29
„
527
+126
21
„
412
+ 72
31
„
648
+121
22
„
518
+106
32
„
686
+ 38
24
„
558
+ 40
34
„
703
+ 17
25
„
609
+ 51
27
„
690
+ 81
2. Versuch. Es kamen etwa 1t,5 geschmolzener
Rohstein in Behandlung und wurden wieder gegen 710k Sand in die Birne eingeworfen. Das Blasen dauerte bei 1k,4 Windpressung auf 1qc 18 Minuten. Die Producte waren denen des 1. Versuches sehr ähnlich; die
Schlacke insbesondere war dicht, schwarz gefärbt und krystallinisch.
3. Versuch. Die Beschickung war hier vollständiger geblasen; angewendet hatte man
gegen 1270k Rohstein bei Zuschlag von 710k Sand; die Windpressung war die frühere. Dauer
des Blasens 17 Minuten.
4. Versuch. Der Rohstein wurde 6 Minuten lang überblasen; Sandzuschlag war
unterblieben und etwa 1000 bis 1250k Rohstein
waren in Arbeit genommen. Die Schlacke war weniger basisch und weit weniger
krystallinisch als die gewöhnlich fallende; das Kupfer darin war vorwiegend als Oxyd
erhalten.
In den folgenden, die Versuche 3 und 4 betreffenden Analysen ist auch die
Zusammensetzung des Sublimates angegeben, welches sich an der Thonglocke über der
Birne absetzte und welches, obwohl das Spectrum beim 4. Versuche so stark auf Kupfer
reagirte, doch nur wenig davon enthält. Das Blei scheint als Schwefelblei
übergegangen und dieses erst nach dem Absatz durch die heiſse Luft oxydirt zu sein,
welche während der Zeit des Ueberblasens wohl nicht mehr völlig entsauerstofft aus
der Birne kam.
3. Versuch
Concentrationsstein
Schlacke
Schwefel
22,22
Eisen, metallisch
49,30
Eisen
12,56
Kupfer, „
1,55
Kupfer
62,36
Zinkoxyd
0,98
Zink
0,42
Manganoxydul
0,30
Blei
0,14
Arsen
0,00
Unlösliches
0,28
Kalk
0,63
Sauerstoff u. nicht Bestimmtes
2,02
Thonerde
1,08
––––––
100,00
Kieselsäure
29,55
Schwefel
6,67
Magnesia, Sauerstoff und nicht Bestimmtes
9,94
–––––––
100,00.
4. Versuch
Schlacke
Sublimat
KieselsäureEisenoxydulEisenoxyd
34,34 25,10 33,83
43,27 Fe
BleisulfatSchwefelbleiZinkoxyd
52,08 17,29 21,78
50,91 Pb(17,47 Zn)
Manganoxydul
0,12
Kupferoxyd
0,09
( 0,07 Cu)
Thonerde
1,81
Eisenoxyd
2,86
Zinkoxyd
0,73
Unlösl. Rukstände
2,14
Kupferoxyd
2,39
(1,91 Cu)
Unbest. u. Verlust
3,76
Bleioxyd
0,03
––––––
Kalk
0,24
100,00.
Magnesia
0,30
Schwefel
0,15
Arsen
0,00
Phosphorsäure
0,031
Nicht bestimmt
1,45
––––––––
100,521.
Temperaturen
3. Versuch
4. Versuch
3
Uhr
58
Min.
60°
(Zunahme)
5
Uhr
28
Min.
97°
(Zunahme)
4
„
–
„
86
+ 26°
„
29
„
136
+ 39°
„
1
„
121
+ 35
„
31
„
193
+ 57
„
2
„
177
+ 56
„
32
„
311
+ 118
„
3
„
219
+ 42
„
33
„
348
+ 37
„
5
„
296
+ 77
„
35
„
559
+ 211
„
6
„
346
+ 50
„
37
„
643
+ 84
„
7
„
422
+ 76
„
39
„
694
+ 51
„
9
„
479
+ 57
„
41
„
765
+ 71
„
10
„
550
+ 71
„
42
„
796
+ 31
„
12
„
726
+ 176
„
44
„
802
+ 6
5. Versuch. Man arbeitete mit gegen 1016k Rohstein
bei Zuschlag von 610k Sand. Dauer des Blasens 12
Minuten; Windpressung 1k,23 auf 1qc. Acht in 10 Minuten abgelesene Temperaturen
bginnen mit 151° und endigen mit 734°. Die Untersuchung des concentrirten Steines
gab:
Kupfer
63,43
Eisen
13,20
Schwefel
20,37
Unlösliches
1,20
Zink. Silber und nicht Bestimmtes
1,80
–––––––
100,00.
Drei Kupellationen dieses Steines gaben in 1000k:
g
g
1670,061
Silber
und
29,640
Gold
1640,058
„
„
34,952
„
1655,070
„
„
32,464
„
Der Stein enthielt 0,12 Proc. metallisches Kupfer, welches in
1000k an Silber 6160g,323 enthielt, an Gold dagegen nur Spuren und
zwar im höchsten Betrage von 3g,06.
Schlacke
EisenoxydulKupferSchwefelKalkKieselsäureZink,
Blei, Thonerde und nicht Bestimmtes
67,17 0,87 1,08 0,07 28,53 2,28––––––100,00
Eine kleine Menge Eisen war anSchwefel gebunden
gegenwärtig;auch war etwas Eisenoxyd vor-handen. Der ganze Betrag
ist als FeOberechnet.
Vom vorhergegangenen Versuche waren Schlackenuberreste
in der Birne geblieben- daher mag es kommen, daſs die erhaltenen Producte etwas von
den übrigen abweichen.
6. Versuch. Man behandelte gegen 1016k Rohstein mit
einem Zuschlag von etwa 560k Sand, der mit
Schaufeln während des 11 Minuten andauernden Blasens eingeworfen wurde. Die Trennung
der ausgekippten Producte erfolgte ganz ähnlich wie beim 1. Versuch, und es ist sehr
bemerkenswerth, daſs in der mittleren Zone, wo man wiederum ein Gemenge von Stein
und Sehlacke hatte, weder Gold noch Silber enthalten war. Die Analysen gaben:
Schlacke
Gemenge von Stein und Schlacke
Kupfer
0,42
5,20
Eisenoxydul
67,52
70,42
Kieselsäure
26,22
14,67
Thonerde
2,46
1,57
Schwefel
2,06
4,17
Sauerstoff, Verlust
1,32
3,97
––––––––
–––––––
100,00
100,00.
Durch Kupellation kein Gold und kein Silber.
Concentrationsstein
Kupfer,
an Schwefel gebunden
59,71
„
metallisch
0,27
–––––
59,98
Eisen
13,16
Schwefel
21,94
Unlöslicher Rückstand (Sand und Eisenoxyd)
2,57
Silber und Gold
0,152
Sauerstoff und Verlust
2,198
–––––––
100,00.
Auf der Kapelle erhielt man im Stein auf 1000k:
g
g
g
Silber
1480,061
1475,022
1477,510
Gold
39,991
34,314
37,540.
Im Rückblick auf die mitgetheilten Analysen der Steine beider Arten ist über die
Rohsteine zu bemerken, daſs sich dieselben schon bei flüchtiger Betrachtung als
Monosulfuret darstellen (mit einer geringen Beimischung von Halbschwefelkupfer).
Doch findet man bei näherer Prüfung, daſs immerhin etwas, wenn auch nicht viel,
Schwefel fehlt.
Von den Concentrationssteinen zeigen sich diejenigen der Versuche 1 und 2 in der
Zusammensetzung gut übereinstimmend. Ich finde bei beiden das Verhältniſs der
Atommengen (= Procentzahl/Atomgewicht) von Cu:Fe:S ziemlich angenähert = 4:16:11,
wenn man die Quotienten für Zink, Blei und Mangan mit dem für Eisen vereinigt.
Dieses Verhältniſs schlieſst eine einfache Formel aus, nach welcher man, wie bei
vielen Steinen, nur Einfach-Schwefeleisen mit Halbschwefelkupfer erhält. Doch würde
die Formel (2Cu2S,7Fe2S),2FeS dem obigen Verhältnisse entsprechen.Rammelsberg läſst in ähnlichen Fällen mehrfach
das Halbsulfuret des Eisens zu. Der Concentrationsstein Nr. 3
entspricht nur angenähert der Formel 2Cu2S,FeS. Der
concentrirte Stein Nr. 5 entspricht nach Abzug des metallischen Kupfers der nicht
eben einfachen Formel (51Cu2S,11Fe2S),2FeS und endlich fügt sich das Product des
Versuches 6 recht gut der Formel 2Cu2S,FeS, welcher
wir schon unter 3 begegneten.
Beim 5. Versuche, wo der geringen Beschickung von etwa 1016k Rohstein zufolge nur eine verhältniſsmäſsig
dünne Schicht geschmolzener Masse über den Fernen der Birne stand, sind 2 Gasproben
genommen, die eine (a)
nach sechs, die andere (b) nach 12 Minuten des Blasens, letztere gerade im
Augenblicke des Kippens der Birne. Frankland fand:
a
b
c
Stickstoff
86,00
88,37
88,70
Schweflige Säure
14,00
10,88
11,30
Kohlensäure
–
–
–
Kohlenoxyd
–
–
–
Sauerstoff
–
0,75
–
––––––
––––––
–––––––
100,00
100,00
100,00.
Hollway schreibt den geringen Sauerstoffgehalt in b dem
Umstände zu, daſs beim Kippen des Apparates die atmosphärische Luft zu der die Gase
fangenden Thonglocke des Aspirators theilweise Zutritt fand, was glaubhaft
erscheint. Die corrigirte Analyse c gibt dann nach
Beseitigung von 3,7 Proc. atmosphärischer Luft das wirkliche Verhältniſs an. Man
sieht nun durch Vergleichung von a und c, daſs zu Ende des Blasens weniger
Sauerstoff zur Bildung von schwefliger Säure verbraucht wird als zu Anfang, folglich
ebenso anfangs weniger Sauerstoff zur Bildung von Metalloxyden verbraucht werden
kann als am Schlüsse. Hieraus ist zu schlieſsen, entweder daſs zu Beginn des Blasens höher mit Schwefel gesättigte und zu
Ende weniger gesättigte Sulfurete verbrennen, oder daſs
bei Beginn des Blasens Schwefel vorwiegend oxydirt wird, die Oxydation der Metalle
aber, im Verhältniſs zum Schwefel, vorläufig rückständig bleibt und sich niedere
Schwefelungsstufen bilden. Was den ersten Fall anbetrifft, so ist allerdings das
niedriger gesättigte Halbschwefelkupfer (Cu2S)
erheblich beständiger als das Einfach-Schwefeleisen (FeS). Da aber, gegen die
gesammte Menge des Kupfers gehalten, nur ganz unerhebliche Antheile von Kupfer
verschlackt sind, also auch nur wenig Schwefelkupfer zerlegt ist, so muſs man,
glaube ich, den ersten Theil der obigen Alternative verwerfen und den zweiten gelten
lassen. Alsdann aber bleibt, da man Halbschwefelkupfer von Anfang bis zu Ende des
Blasens bestehend annehmen muſs – immer vorausgesetzt, daſs man die Ladung nicht
überblasen hat – und sonstige Schwefelmetalle so gut wie gar nicht in Betracht
kommen, nur die Möglichkeit übrig, daſs das Eisenmonosulfuret selbst nach und nach
in niedere Schwefelungsstufen theilweise übergeht, wie dies auch die aus den
Analysen von mir berechneten Formeln andeuten. Es scheint, daſs dann diese niederen
Sulfurete des Eisens zu Ende des Blasens ganz vorwiegend von dem Sauerstoff in
Anspruch genommen werden. Berechnet man nämlich aus c die Gasgewichte, so erhält
man:
88,7
Vol.
N
entsprechend
111,4959
G.-Th.
11,3
„
SO2
„
32,3293
In letzterem Betrage hat man O:
16,1646
Nach dem bekannten Verhältniſs von N zu O in atmosphärischer Luft mutete man auf
111,4959 G.-Th. Stickstoff haben 33,6540 G.-Th. Sauerstoff. Mithin sind
verbraucht:
16,1646
G.-Th.
O
zur
Bildung
von
SO2,
entsprechend
16,1646
S.
17,4894
„ „
O
„
„
„
FeO,
„
61,2129
Fe.
Das Atomverhältniſs der letzteren ist 1,010 für den Schwefel und 2,186 für das Eisen,
was wiederum auf Halbschwefeleisen (Fe2S) hinweist,
kaum auf Eisenmonosulfuret.
Nach der der Analye der Schlacke vom 5. Versuch, für welchen ja auch die Gasanalysen
gelten, beigefügten Bemerkung scheint nur wenig Eisenoxyd (welches nicht bestimmt
wurde) zugegen gewesen zu sein, so daſs sich das Resultat der Rechnung von diesem
Gesichtspunkte aus nicht wesentlich verschieben lassen dürfte.
Nach der Analyse a gibt eine ähnlich durchgeführte Rechnung:
20,054
G.-Th.
O
zur
Bildung
von
SO2
verbraucht
12,576
„ „
O
„
„
„
FeO
„
Hier stehen die äquivalenten Mengen von Schwefel und Eisen im Verhältnisse von 4:5
(Fe5S4 =
3FeS,Fe2S). Ich möchte mit diesen Formeln
positive Sätze über chemische Vorgänge nicht hinstellen; ich glaube nur, daſs sie
vortrefflich zeigen, in welcher Weise der Sauerstoff des Windes in Anspruch genommen
wurde. Eine gröſsere Reihe von Gasanalysen würde den Verlauf des ganzen Processes
neben den analysirten festen Producten vorzüglich aufklären. Hollway meint, daſs es scheine, wie unter den vorliegenden Bedingungen
Eisen mehr oxydirbar sei als der mit ihm verbundene Schwefel und zuerst verbrenne.
Die vorliegenden Rechnungen zeigen aber das Gegentheil.
Weitere Versuche fanden im November 1878 statt. Etwa 2032k Rohstein wurden ohne Zuschlag 5 Minuten lang geblasen und dann 4064k kalter Schwefelkies in groſsen Stücken nach und
nach nebst etwa 460k Sand (mit 16 Proc.
Feuchtigkeit) eingeworfen. Trotz des hohen Verbrauches an Wärme blieb die Masse
flüssig und wurde nach einiger Zeit weiteren Blasens halb ausgekippt. Man setzte
hierauf fernere 915k Schwefelkies in Stücken und
150k Sand zu und konnte nach kurzer Zeit des
Blasens die ganze Masse wieder auskippen. Bei einem folgenden Versuche hatte man die
nachträglich zuzufügenden Materialien zu früh eingeworfen, die Masse erstarrte durch
zu heftige Abkühlung und muſste mit Kohlen wieder in Fluſs gebracht werden.
Die Producte dieser letzten Versuche waren theilweise überblasen, wahrscheinlich
davon herrührend, daſs beim Auskippen der Massen verhältniſsmäſsig mehr Stein als
Schlacke austrat. Ein Theil der letzteren wurde so wieder mit geblasen, sie verlor
an Schwefel und ein Theil des Eisensoxyduls ging in Oxyd über, indem die hierbei
frei werdende Wärme genügte, den Schmelzfluſs zu erhalten. Der gewonnene Stein, noch
nicht hinlänglich geblasen, enthielt nur 8,4 Proc. Kupfer, die überblasene Schlacke
dagegen 2,36 Proc. Kupfer und nur 0,25 Proc. Schwefel. Da letzterer Betrag nicht
ausreicht, um das Kupfer als Halbschwefelkupfer zu binden, so war ein Theil Kupfer
verschlackt. Bei dem
letzten Versuche erhielt man auch sehr schön krystallisirte Schlacken (in dünnen
Tafeln von fast 25mm Durchmesser), die sich in der
Zusammensetzung dem Singulosilicat nähern (2FeO,SiO2), welchem sich auch im Ganzen genommen die Schlacken der im Juli
angestellten Versuche anschlieſsen. Eine eigenthümliche Schlacke von metallischem
Ansehen wurde in einem Falle erhalten; sie zeigte die Form von Prismen. Die
ZusammensetzungGefunden:Formel verlangt:FeS 6,10 6,09SiO228,9929,08FeO mit 2,78 MnO und ZnO64,1264,82Kupfer, Thonerde, Unbestimmtes–––––––––––––99,9999,21 entspricht der Formel (13FeO,FeS),7SO2, ein Singulosilicat, in welchem ein Eisenoxydul durch ein
Eisenmonosulfuret vertreten ist.Im Helvin, welcher in regulären Tetraëdern krystallisirt, hat man ebenfalls
eine Verbindung von Monosulfureten mit Silicaten; die Zusammensetzung ist
aber 3(MnO,FeO)2,SiO2 + Be2O32,SiO23 +
2(Mn,Fe)S. Das specifische Gewicht war nach zwei Bestimmungen
4,19 und 4,22.
Wenn man, wie Hollway will, den Sauerstoffverbrauch
hauptsächlich nach der Reaction FeS + O3 = SO2 + FeO stattfinden läſst (was aber, wie gezeigt
worden ist, schon in der Mitte des Versuches nicht mehr zutrifft), so berechnet sich
das Maximum an schwefliger Säure in den Birnengasen zu 15 Vol.-Proc. Die Verbrennung
in den Kiesöfen der Schwefelsäurefabriken kann man, vom Luftüberschuſs abgesehen,
ausdrücken durch 2FeS2 + 110 = Fe2O3 + 4SO2, wonach sich 16,1 Vol.-Proc. schweflige Säure
ergeben. Der fernere Zuschuſs an Luft, falls man mit Hollway an Schwefelsäure-Erzeugung denkt, wäre in beiden Fällen gleich,
auf die Gewichtseinheit schwefliger Säure bezogen. Immerhin aber glaube ich, daſs
man die Birnengase durchschnittlich nur mit 13 Vol.-Proc. schwefliger Säure in
Anrechnung bringen dürfte, und alsdann erhält man daraus geeignete Bleikammergase
von 7 Vol.-Proc. schwefliger Säure, während Kiesöfen solche, rechnungsmäſsig, von
etwa 9 liefern, beide Male 6 Vol.-Proc. Sauerstoff auf die ganze Stickstoffmenge
gerechnet.
Man müſste somit für Birnengase mehr Bleikammerraum bewilligen oder mehr Salpeter
brauchen, als für Kiesofengase.Die Verwendung solcher Birnengase für Bleikammerbetrieb kann ich aber nicht
für eine so ganz einfache Sache halten, als sie hingestellt wird.
Auſser für Bleikammerbetrieb, der allerdings in den wenig gewerbfleiſsigen Gegenden,
für welche Hollway seinen Proceſs berechnet, auch nur
eine verhältniſsmäſsig kleine Menge Schwefel beseitigen würde, erwähnt der Erfinder
noch die Verwendung der schwefligen Säure für Hargreaves' Proceſs der Natronsulfat-Bereitung. Dieser setzt aber auch
wieder einen groſsen J erbrauch an Sulfat voraus, das nicht viel Transport verträgt
und für schweflige Säure Salzsäure gibt, die dem Producenten in Hinsicht auf Condensation und
Verwerthung neue Sorgen macht; ferner die Reduction der schwefligen Säure zu
Schwefel durch Schwefelwasserstoff, letzterer erhalten durch Eintreiben von
Wasserdampf in das zu behandelnde Schwefelmetall – ein Vorschlag, welcher sich, die
technischen Schwierigkeiten beiseite gesetzt, eher hören läſstWeil man damit in der Menge der zu verarbeitenden schwefligen Säure ziemlich
unbeschränkt ist. Die praktische Ausführung wird aber immerhin nicht geringe
Schwierigkeiten bieten, weil das Verhältniſs von schwefliger Säure zu
Schwefelwasserstoff richtig getroffen werden muſs.; endlich die
Absorption der schwefligen Säure durch Wasser und mit daran sich schlieſsender
Erzeugung von flüssiger schwefliger Säure, wobei es aber auch noch wünschenswerth
bleibt, daſs sich die Anwendungen derselben in diesem Zustande noch recht sehr
verallgemeinern möchten.In einer Nachschrift kommt Hollway gelegentlich
der Verwendung der schwefligen Säure auch auf die Fabrikation von
Superphosphat aus Estremadura-Phosphat und Schwefelsäure. Freilich gestattet
diese Fabrikation den Verbrauch groſser Mengen Schwefelsäure, mithin die
Beseitigung groſser Mengen schwefliger Säure. Immerhin ist aber zu erwägen,
daſs diese Fabrikation, in England ausgeübt, an Fracht für Rohstoff nur
Rohphosphat und Schwefelkies zu rechnen hat. Setzt man, in runden Zahlen,
auf 100 Rohphosphat 80 Kammersäure und auf 100 Schwefelkies 210 Kammersäure,
so hat der englische Fabrikant auf 100t
Superphosphat Auslage an Fracht für 47t,3
Rohproducte zu rechnen, letztere von einer solchen Beschaffenheit, daſs sie
schwerlich durch Havarie an Werth verlieren dürften. Soll dagegen das in
Spanien erzeugte Superphosphat in England abgesetzt werden, so beträgt die
Fracht statt 47t,3 nunmehr 100t und das Frachtobject ist von einer für
Havarie sehr empfindlichen Beschaffenheit. Dazu ist noch zu bemerken, daſs
in der Fabrikation künstlicher Düngestoffe, obschon sie bisher im Ganzen und
Groſsen noch ziemlich gut prosperirte, sich neuerdings ebenfalls eine höchst
gedrückte Geschäftslage anzeigt.
Im Februar 1879 wurden weitere Versuche gemacht. Man brachte, nachdem die erste
Ladung zufällig überblasen und mit Hilfe von Kohle theilweise wieder erweicht und
mit Stangen aus der Birne geschafft war, 100k
Kohlen in das Gefäſs und fügte Stücke von (kaltem) Kies zu. Nach Wiederaufnahme des
Blasens sammelte sich am Boden der Birne Rohstein an und 8 Stunden lang wurde dann
fortwährend weiter Kies und Sand eingeworfen. 20 Minuten lang muſste wegen
Beschädigung eines Dampfrohres das Blasen eingestellt werden; doch war die Masse
flüssig geblieben und man konnte die Operation ohne Schwierigkeit fortsetzen. Gegen
18t,25 Schwefelkies waren in dieser Zeit
behandelt und wahrscheinlich über 8t,1 Schwefel
waren verbrannt worden. Am Maul der Birne brannte fortwährend eine blaue
Schwefelflamme, deren Inneres aber einen Stich ins Grüne zeigte, hervorgerufen durch
die Verdeckung des inneren (pomeranzgelben) Schwefeldampfes durch das äuſsere
Blau.
Im Anschlüsse an den letzten Versuch berechnet nun Hollway die Wärmemengen und Temperaturen, welche durch Verbrennung
verschiedener Schwefelmetalle entstehen. Ich führe jedoch nur das Beispiel für
Eisenmonosulfuret an und brauche über den Modus der Berechnung nichts hinzuzufügen,
da die Rechnung selbst ihn kenntlich macht. Die Verbrennungswärme des Schwefels
(nach Favre und Silbermann) zu 2220c und diejenige des
Eisens (nach denselben) bei seiner Verbrennung zu FeO mit 1353c gesetzt, erhält man:
Für 16 + 28 = 44 Th. Schwefeleisen (28 × 1353) + (16 × 2220) =
73404c
Durch Verbindung von Eisen mit Schwefel zu FeS werden auf 1 Th.
Eisen nach Favre und Silbermann 634c frei, bei
der Zerlegung mithin ebenso viel latent; auf 28 Eisen
somit
28 × 634 =
17752
––––––
Verbrennungswärme von 44 FeS =
55652c.
Somit für 1 Th. FeS
=
1265c.Hollway findet 1217c,9 und als Temperatur 2225°. Ich
habe, obschon nur Berichterstatter, mich nicht entschlieſsen können,
die Zahlenunterlagen ohne Controle anzunehmen und mich daher solcher
Zahlen bedient, die ich selbst erlangen konnte (meist nach A. Naumann in Gmelin-Kraut's Handbuch der Chemie).
Durch die Verbrennung entstehen: 32 Th. schweflige Säure, 36 Th.
Eisenoxydul und 53 Th. Stickstoff, aus atmosphärischer Luft zurückgelassen. Die
bezüglichen specifischen Wärmen sind 0,1553 bezieh. 0,14Für Eisenoxydul; berechnet aus der Atomwärme des Zinkoxydes (= 5,05) unter
der Annahme, daſs dieselbe gleich der des Eisenoxyduls. und
0,2438. Man erhält also als Summe (32 × 0,1553) + (36 × 0,14) + (53 × 0,2438) =
21,931 und die Verbrennungstemperatur des Eisenmonosulfurets = 55652:21,931 =
2427°.
In ähnlicher Weise findet Hollway für
Zinkblende 1992°, für Bleiglanz 1863°. Für Kohle mit 80 Proc. Kohlenstoff, 5 Proc.
Wasserstoff und 15 Proc. Asche (deren Wärmecapacität zu 0,2 und die Wärmeabsorption
bei Zerlegung des Kohlenwasserstoffes auf 5 G.-Th. Wasserstoff 1870c gesetzt) 2787°.
Zu diesen Zahlen ist aber zu bemerken, daſs sie unter Voraussetzungen erhalten sind,
die eigentlich sich mehr einem Röstprocesse, als einem Schmelzprocesse nähern; es
ist keine Rücksicht genommen auf die erzeugten Producte, Stein und Schlacke.
Aehnliches gilt auch von dem folgenden Versuche einer Berechnung der Endtemperatur
bei einer Bessemercharge.Wobei ich in Folge der theilweisen Anwendung anderer Zahlen unter Hollway's Resultat von 2748°
bleibe.
Vorausgesetzt ist ein Roheisen mit 4,2 Proc. Kohlenstoff, 2,8
Proc. Silicium und eine Eisenverbrennung von 7 Proc., so daſs 86 Proc. Eisen übrig
bleiben. Das Eisen soll mit 1650°, der Gebläsewind mit 50° in die Birne kommen. Es
entstehen 9,8 Proc. Kohlenoxyd, 6,0 Proc. Kieselsäure, 10,0 Proc. Eisenoxyd, 39,1
Proc. Stickstoff bei einem Verbrauch von 11,8 Proc. Sauerstoff. Die angesetzten
specifischen Wärmen und Verbrennungswärmen erkennt man aus dem Ansätze leicht
heraus. Die vorhandene und zugebrachte Wärmemenge ist nun zunächst: (100 × 0,1138 ×
1650) + (4,2 × 2470) + (2,8 × 7830) + (7 × 1855) + 50 [(39,1 × 0,2438) + (11,8 ×
0,21751)] = 64665c.
Die Summe der specifischen Wärmen ist: (9,8 × 0,2450) + (6 ×
0,186) + (10 × 0,1692) + (39,1 × 0,2438) + (86 × 0,1138) = 24,528 und somit die
Endtemperatur = 64665:24,528 = 2636°.
Die Zunahme wäre sonach 2636 – 1650 = 986°. Wedding (Eisenhüttenkunde,
Bd. 3 S. 441) findet mit exacterer Rechnung und etwas anderen Grundzahlen 802° und
Rinmann (daselbst S. 441) 890°.Mit Hollway's Zahlen ergaben sich
1098°.
Eine mehr den wirklichen Verhältnissen sich anpassende Berechnung
von Akerman stellt sich folgendermaſsen, wenn der
Schwefelkies mit 90 Proc. Bisulfuret (also 48 Proc. Schwefel und 42 Proc. Eisen) und
10 Proc. fremder Substanz (deren specifische Wärme = 0,15 genommen) und wenn von der
Schlackenbildung abgesehen die Reaction 5FeS2 + 12O
= FeS + 4FeO + 4SO2 + 5S zu Grunde gelegt wird.Diese Gleichung entspricht indessen nicht den Verhältnissen, nach welchen
später Hollway für den Betrieb rechnet. Denn 5
Aeq. Schwefelkies = 300 G.-Th. mit 4,5 G.-Th. Kupfer würden hier die groſse
Menge von 1 Aeq. Monosulfuret = 44 G.-Th. mit 4,5 G.-Th. Kupfer geben. Der
Gehalt des erblasenen Steines betrüge somit nur etwa 10 Proc. Kupfer. Hollway legt später für die Betriebscalculation
einen Stein von 33,33 Proc. Kupfer unter, welcher auſserdem noch 29,59 Proc.
Schwefel und 37,08 Eisen enthalten würde. Besteht nun der Rohkies aus 10
Proc. fremden Substanzen, 1,5 Proc. Kupfer und dem Rest als Bisulfuret, so
braucht man, um einen Stein von genannter Zusammensetzung zu erzielen,
(statt 300) 2222,22 G.-Th. Rohkies. Alsdann sind zu oxydiren 880,70 G.-Th.
Eisen und 1132,30 G.-Th. Eisenoxydul zu verschlacken (= 1604,2 G.-Th.
Schlacke); zu oxydiren 503,25 G.-Th. Schwefel zu 1006,50 G.-Th. schwefliger
Säure; zu verdampfen 503,25 G.-Th. Schwefel; einzublasen 754,85 G.-Th.
Sauerstoff mit 2500,80 G.-Th. Stickstoff; zuzuschlagen 471,80 G.-Th.
Kieselsäure. Nimmt man dann noch (mit Wedding:
Eisenhüttenkunde, Bd. 3 S. 438) die specifische Wärme der Schlacke
zu 0,33 und den Wärmegehalt des Steines, wie er den Ofen verläſst, zu 270c (vgl. Dürre
1876 220 249), so wird das Resultat ein erheblich
ungünstigeres. Die Temperatur des Windes ist zu 50°, die
Verbrennungswärme des Eisens, wenn es zu Oxydul verbrennt, zu 1280c gerechnet.
Man findet an entwickelter Wärme: (48
× 0,4 × 2220) + (42 × 0,8 × 1280) + 50 [(0,240,24 = Specifische Wärme des Sauerstoffes, die aber nur 0,21751
beträgt. × 28,8 Sauerstoff) + (0,244 × 95,4 StickstoffIm Original 96,4 Stickstoff.)] =
87133c.
Für verbrauchte Wärme kommt in
Betracht die latente Schmelzwärme (= 30c nach Akerman), sodann die Wärmemenge zur Zerlegung von
FeS2 in FeS und S – rückwärts zu berechnen aus
der Verbindungswärme (200c nach Akerman) von FeS zu FeS2 – endlich der Wärmeverbrauch zur Zerlegung von FeS in Fe und S (nach Favre und Silberman 634c auf 1 Eisen, wenn Monosulfuret entsteht). Ferner
hat man die Wärmeverluste für die Verdampfung des Schwefels anzusetzen (dessen
Verdampfung bei 420° und dessen specifische Wärme mit 0,178; die latente Dampfwärme
= 300c und schlieſslich die von 38,4 schwefliger
Säure und 95,4 Stickstoff bei 600° (nach Akerman)
entführten Wärmemengen. Der ganze Betrag ist: (30\times 100)+(200\times 66\
[\mbox{Monosulfuret}])+(634\times 66\times 0,8+\frac{28}{44})+(48\times
0,5\times 0,178\times 420)+(48\times 0,5\times 300)+600\ [(38,4\times
0,155)+(95,4\times 0,244)]=64034^c. Es bleiben somit übrig
87133-64034=23099^c.
Die Summe der specifischen Wärmen der übrig bleibenden festen
Producte – immer von den Schlacken abgesehen – ist (42\times 0,8\times
\frac{36}{28}\times 0,167So
setzt Akerman die specifische Wärme des
Eisenoxyduls.)+(42\times 0,2\times \frac{44}{28}\times
0,136Specifische Wärme
des Monosulfurets, nach Regnault.)+(10\times 0,15)=10,5096 und somit
die Endtemperatur 23099:10,5096=2198^{\circ}.
Um die Schlackenbildung zu befördern, können kieselsäurehaltige
arme Erze, alte Schlacken, Gangart mit noch etwas Erzgehalt u.s.w. zugeschlagen
werden, deren nutzbare Metalle dann theils im Concentrationsstein, theils im
Sublimat mit gewonnen würden. Der Procentsatz an solchen Zuschlägen kann wegen ihrer
geringen specifischen Wärme (= 0,15 nach Akerman's
Meinung) ein sehr erheblicher sein. Nimmt man 1000° als die für den Proceſs
erforderliche Temperatur an, so darf die Summe der specifischen Wärmen betragen 23099 : 1000 = 23,099,
wovon als Rest für die Zuschläge bliebe 23,099 – 10,5096 = 12,59. Man dürfte sonach
12,59 : 0,15 = 83,8 Proc. solcher Zuschläge, mehr als ⅘ vom behandelten Erz,
zubringen.
Würde man den Gebläsewind mit 500° anwenden, so stellt sich die
verfügbare Wärmemenge auf 23099 + 450 [(38,4 × 0,155) + (95,4 × 0,244)] = 36680°.
Die entsprechende Temperatur würde 36680 : 10,5096 = 3490° betragen, und um alsdann
bei der festen Grenze von 1000° zu bleiben, wäre ein Zusatz von (36,680 – 10,509) :
0,15 = 174 Proc. solcher Zuschläge gestattet.Bei der Besprechung von Hollway's Versuchen und
Projecten äuſsert sich Allen aus Sheffield
dahin, daſs statt 1000° besser 1200° als die für den Proceſs nothige
Temperatur anzusehen sei.
Die Steigerung an Zuschlägen würde nur günstig auf den Verlauf der
Schmelzungen einwirken. 20k Kiese dürften etwa
12k Eisenoxydul und dieses mit 38k Fluſsmittel (mit Gehalten an Kalk, Thonerde und
Magnesia) würde eine Schlacke von etwa 30 Proc. Eisenoxydul, 30 Proc. an sonstigen
Basen und 35 bis 40 Proc. Kieselsäure geben. Das specifische Gewicht dieser Schlacke
würde nur 3,2 ausmachen und eine viel bessere Sonderung von Stein und Schlacke würde
die Folge sein.
Ueber Anlagekapital und Betriebskosten einer Anlage für die Behandlung von 304800t Erz von nicht unter 1½ Proc. Kupfer in Spanien
stellt Hollway folgenden Ueberschlag an.
Kohlen. Für den (kalten) Gebläsewind 20320t und 11176t zur
Erwärmung desselben auf 538°. Die Erze enthalten 1,5 Proc. Cu und 90 Proc. FeS2. Letztere geben 66 Proc. Stein (FeS), von welchen
60 Proc. zu oxydiren sind; 3 Proc. gehen in die Schlacke und 3 Proc. bleiben im
concentrirten Stein, welcher alsdann über 30 Proc. Kupfer enthalten wird (nämlich 3
Th. Rohstein + 1,5 Th. Kupfer = 4,5 Th. Concentrationsstein mit 33⅓ Proc.
Kupfer).
60 Th. Rohstein (FeS) erfordern 32,7 Th. Sauerstoff (wenn man die
Reaction FeS + O3 = FeO + SO2 gelten läſst); man hat also auf 1t Erz 1t,391
Luft nöthig; statt dessen sind für den Kohlenbedarf 1t,6 gerechnet. Für 50 Wochen (zu 160 Stunden) im Jahr findet man 1016k Luft die Minute (rund 800cbm, im Original 830cbm). Die Gebläsecylinder müſsten hierfür im Ganzen 7qm,3 Querschnitt erhalten bei einer
Kolbengeschwindigkeit von 114m in der Minute. Nach
den Bemerkungen eines Fachmannes ist der mittlere Druck mit 1k,195 auf 1qc
anzunehmen, wenn die Cylinder mit 1k,757 blasen.
Nach den englischen Maſsen resultiren 2178e
(indicirte) oder mit 10 Proc. Zuschlag für die Reibung der Maschine 2395e (indicirte). Für Maschinen nach dem
Compoundsystem werden 1k,016 Kohlen auf 1e stündlich gesetzt, so daſs für 8000 Stunden
jährlich 19200t Kohle nöthig sind (wofür 20320t angesetzt wurden). Bei stündlich 11k,176 Wasserdampf auf 1e (indicirt) ist der gesammte Dampfbedarf
stündlich 26767k und bei der Verdampfung von 27k,3 Wasser in der Stunde auf 1qm feuerberührter Kesselfläche ist der Bedarf an
letzterer 980qm. In der folgenden
Kostenaufstellung ist man aber, weil schwächere Windpressung angenommen wurde,
wieder unter diesen Betrag herab gegangen.
Hollway beabsichtigt nicht, die Bessemerbirne als solche
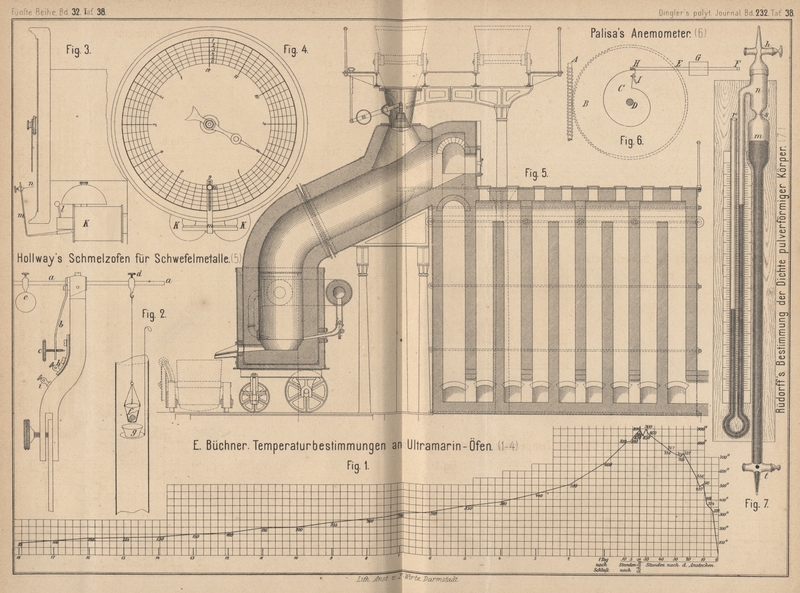
beizubehalten, sondern denkt eine Vorrichtung anzuwenden, wie sie in Fig. 5 Taf.
38 abgebildet ist, bestehend in einem beweglichen Ofen mit geneigt angesetztem
Fuchs, durch welchen die Beschickung herabrollt, und mit einem System von
Staubkammern. Zum Abstechen dient ein fahrbarer Kübel.
Der Anschlag einer Anlage von genannter Gröſse stellt sich auf
137000, höchstens 150000 £, worin 16 Dampfkessel völlig
eingemauert und ausgerüstet mit 10620 £, 3 Paar
Compound-Gebläsemaschinen mit 9200 £, 8 Whitwell'sche
Winderhitzer mit 8000 £, 14 Schmelzöfen mit 10780 £, sowie etwa 5km
Eisenbahn inbegriffen sind.
Ueber den Betrieb legt Hollway folgende Berechnungen
unter.
304800t Kiese mit nicht unter 1½
Proc. Kupfer und mit 47g,965 Silber sowie 0g,191 Gold in 1t
würden liefern 15240t Concentrationsstein mit 30
Proc. Kupfer und 479g,623 Silber, sowie 1g,9135 Gold in 1t. Der Kupferverlust soll 10 Procent des Gesammtkupfers nicht
überschreiten; es bleiben also 13716t Stein zur
Verrechnung.
13716t Stein
mit 30 Proc. Kupfer entsprechen 4115t,8
Kupfer, 1t zu 59 £ 1 Sh.
243000 £
6578k,5 Silber, 1k zu
6 £
10 Sh.
7,8 d.
42970Im Original 84600 £, wonach sich auch
die folgenden Zahlen ändern.
26k,240 Gold, 1k zu
128 „
12 „
–
3375Im Original 6750 £, wonach sich auch die
folgenden Zahlen ändern.
Dazu würden noch 73152t Schwefel kommen, mit 2 £ 19 Sh. für 1t =
216000
–––––––––––
Zusammen
505345 £
Davon ab die Kosten für die Abscheidung des
Kupfers, Silbers und Goldes aus dem Stein
84345
–––––––––––
Bleiben
421000 £
An Auslagen kommen für:
Schwefelkies 304800t mit 5,91 Sh. für 1t
90000 £
Kohle, auf 100t Kies 18t, also 54864t zu 22,63 Sh.
62100
Fluſsmittel, an gewöhnlichem Sande oder
kieselsäurehaltigem Gestein würde auf 3t Kies 1t erforderlich sein, oder 101600t mit 4,92 Sh. für 1t. Es wird jedoch auf den ungünstigsten Fall Rücksicht
genommen, daſs nämlich die Kieselsäure aus dem Futter des Ofens
entnommen werden müſste. Da Sand allein nicht anwendbar ist, so
wären 152400t Masse
zu rechnen; die Kosten eingeschlossen Arbeit des
Ausfütterns und Formen mit 9,84 Sh. für 1t
75000
Von diesem Betrage dürften aber – immer
nach Hollway'sMeinung – wenigstens ⅔
erspart werden, weil man mit den Zu-schlägen werthvolle Metalle in den
Proceſs einführen kann.
Löhne u. dgl., auf 1t Erz 0,984 Sh.
15000
Transport, 13716t Stein nach England zu befördern, zu 19,68 Sh.
13500
Insgemein, einschlieſslich der Entwerthung
Anlage und Zinsen
45400
–––––––––––
Zusammen
301000 £
Der Nutzen würde somit 120000 £
betragen oder 7,87 Sh. für 1t Schwefelkies.Im Original nahezu 11 Sh. für 1t. Der Werth des Sublimates ist, vom Schwefel abgesehen,
unberücksichtigt geblieben. Dasselbe würde wahrscheinlich ein Gemenge von Schwefel,
Schwefelarsen, Schwefelblei und Zinkoxyd, möglich auch von Schwefelzink, bilden mit
Antheilen von Eisenoxyd und Schwefelthallium. Schwefel und Schwefelarsen lassen sich
daraus mit reducirender Feuerung bei mäſsiger Temperatur (500°) abtreiben. Uebrigens
würde der Absatz des Sublimates in. den Staubkammern auch wahrscheinlich von selbst
derart erfolgen, daſs Schwefel und Schwefelarsen in der Hauptsache erst später
niederfallen, als die Schwefelmetalle mit Zinkoxyd. Auſserdem würden noch etwa
121920t schweflige Säure erfolgen.
An den Bericht schlieſst sich ausführliche Mittheilung der Besprechung an, in
Hinsicht auf welche ich jedoch auf die Schrift selbst verweise. Nur sei noch
erwähnt, daſs von einer Seite dem Hollway'schen
Processe nachgesagt wurde, daſs er nicht neu sei und daſs zur Begründung dessen
Bezug genommen wurde auf ein englisches Patent von Keates Nr. 2057 aus dem J. 1856. Nachdem der Gegenstand desselben
anhangsweise mitgetheilt worden und es sich bei diesem Patent um „Entschwefelung von Kupfer
und Kupfersteinen“ auf einem dem Bessemerprocesse ziemlich nahe verwandten
Wege handelt, so bin ich allerdings auch der Meinung, welcher in der Besprechung
Ausdruck gegeben wurde, daſs sich mit Keates' Patent
die Neuheit von Hollway's Verfahren nicht anfechten
läſst. Ich muſs indessen anführen, daſs, nachdem einmal die Frage der Neuheit
angeregt worden, Niemand auf die früheren Veruche Jossa's und den Bericht darüber von Kupelwieser verwiesen hat.
Tafeln