| Titel: | Aus dem Berichte der englischen Sodafabriks-Inspection; von G. Lunge. |
| Autor: | Georg Lunge [GND] |
| Fundstelle: | Band 236, Jahrgang 1880, S. 131 |
| Download: | XML |
Aus dem Berichte der englischen
Sodafabriks-Inspection; von G. Lunge.
(Schluſs des Berichtes S. 54 dieses
Bandes.)
Mit Abbildungen auf Tafel 14.
Lunge, über den Bericht der englischen
Sodafabriks-Inspection.
Groſse Aufmerksamkeit hat Smith dem
Schwefelwasserstoff gewidmet. Er glaubt bestimmt,
daſs dieses Gas nie vollständig vermieden werden könne, so lange das jetzige
Leblanc'sche Sodaverfahren existirt. Das Ammoniak-Sodaverfahren mache Fortschritte;
wenn es durch eine groſse Entdeckung einmal gelingen sollte, Ammoniak aus dem
Stickstoff der Luft und dem Wasserstoff des Wassers zu machen, so werde das
Ammoniakverfahren gewiſs das alte verdrängen; aber diese Zeit scheine nicht nahe
bevorzustehen. Auſserdem müsse man auch dann noch immer die Darstellung des Chlores
berücksichtigen, welches jetzt eine „ungeschickte“ Fabrikation sei, auch noch
nach den Erfindungen von Weldon und Deacon.
Ich kann diesen Ausführungen von Smith nicht ganz
beistimmen. Allerdings kann man es Jemandem, welcher in dem groſsen
Sodafabrikations-Districte von Süd-Lancashire wohnt, nicht verdenken, wenn er an der
Möglichkeit verzweifelt, bei dem Leblanc-Verfahren ohne Entweichen von
Schwefelwasserstoff auszukommen; denn von den dort entstehenden Auslaugerückständen
wird wohl lange noch nicht der zehnte Theil einem Entschweflungverfahren
unterworfen, und auch bei diesem selbst (dem Mond'schen) ist ein Entweichen von Schwefelwasserstoff, sowohl während der
Oxydation als bei der Zersetzung der Laugen mit Säure, nicht immer zu vermeiden.
Daſs es aber in der That möglich ist, ohne Entweichen
von Schwefelwasserstoff auszukommen, zeigt das Schaffner-Helbig'sche Verfahren der Behandlung der Sodarückstände, selbst
wenn dieses erst noch weiterer Verbesserungen bedürfen sollte, um sich allgemeiner
einführen zu können. Was ferner die Verdrängung des Leblanc-Verfahren durch das
Ammoniakverfahren betrifft, so hängt dieses durchaus nicht allein von der Frage der
Ammoniakbeschaffung, sondern wohl noch mehr von derjenigen der Salzsäure und des
Chlores ab. Bis jetzt scheint es nicht, als ob man diese Körper bei dem
Ammoniakverfahren bequem und billig genug aus dem Chlorcalcium erhalten könnte, und die Magnesia, obwohl
oft als Ersatz des Chlorcalciums vorgeschlagen, ist bis jetzt nie ernstlich versucht
worden. Sollte die Salzsäure- und Ammoniakfrage für das Ammoniakverfahren einmal
gelöst werden, was eben noch nicht in Aussicht steht, so würde es natürlich, falls
nicht inzwischen ein anderes noch günstigeres auftritt, das Leblanc-Verfahren so gut
wie ganz verdrängen müssen, und die Schwefelwasserstoff-Frage wäre dann erledigt;
doch bliebe die Beaufsichtigung der Condensation der Salzsäure und des Chlores genau
so nöthig wie jetzt.
Smith beschreibt sehr ausführlich eine Reihe von
Versuchen, welche er angestellt hat, um den schlimmsten Begleiter der
Sodarückstands-Halden, die davon ablaufenden Schwefel haltigen Laugen, unschädlich
zu machen, bezieh. zu verwerthen. Er knüpft an ein System an, das ich in meiner
früheren Fabrik in South-Shields eingerichtet hatte, welche nicht an einem Flusse
oder Bach liegt, und deren Abflüsse in Folge davon in die groſsen Sielkanäle der
Stadt gehen müssen. Dies ist auch der Fall mit der Drainage von einer groſsen
Sodarückstands-Halde hinter der Fabrik, welche sehr reich an Sulfiden ist und in der
an Kohlensäure reichen Luft der Siele so viel Schwefelwasserstoff ausgibt, daſs
ernstliche Klagen daraus entstanden. Die localen Umstände verboten den Gedanken
einer ökonomischen Verwerthung dieser Drainage; es gelang mir aber dieselbe völlig
unschädlich zu machen dadurch, daſs sie abwechselnd in eine von drei Gruben geleitet
wurde, in der sie mit dem Absatzschlamme der Manganlaugen des Weldon-Processes
vermischt wurde. Dieser Schlamm enthält kohlensauren Kalk, Eisenoxydhydrat und etwas
Manganoxyde. Den gebrauchten Schlamm lieſs ich an den Rand der Gruben werfen und
dort stets durch die Luft regeneriren. Dieses freilich nur rohe Verfahren war seinem
Zwecke ganz entsprechend und ist in der That auch seit einer Reihe von Jahren in
Ausführung geblieben; dabei gewinnt man aber kein nützliches Product und hat noch
Arbeitslohn zu bezahlen.
Smith, welcher das Verfahren an Ort und Stelle
untersuchte, kam nun auf den Gedanken, es zu einem continuirlichen zu gestalten,
indem er die Schwefel haltigen Laugen mit ein wenig Manganoxyd zusammenbrachte und
einen Luftstrom durchleitete, welcher das gebildete Mangansulfür fast momentan
wieder oxydirt. Dabei bildet sich neben freiem Schwefel auch stets
unterschwefligsaurer Kalk, um so mehr, je weniger Mangan man anwendet; aber
jedenfalls werden die Sulfide durchaus zerstört, ohne daſs sich eine Spur von
Schwefelwasserstoff entwickelte.
Wie man sieht, ist Smith's Verfahren durchaus identisch
im Princip mit demjenigen von Pauli zur Entschweflung
von Sodarohlaugen, welches zuerst am 4. April 1879 in England patentirt wurde. Daſs
hier eine von der Pauli'schen völlig unabhängige
Beobachtung vorliegt, kann ich verbürgen, wenn dies bei einem Manne wie Angus Smith überhaupt nöthig wäre; denn er setzte mir
das ganze, erst jetzt von ihm veröffentlichte Verfahren schon im April 1878 aus
einander, als ich ihn in Manchester besuchte. Ferner hat schon Weldon einen ganz ähnlichen continuirlichen Proceſs
beschrieben, wie Smith selbst hervorhebt, aber mit
Anwendung von Eisenoxyd, welches lange nicht so vortheilhaft wirkt wie
Manganoxyd.
Smith's Versuche wurden im Kleinen in einem Apparate
gemacht, welcher im Originalbericht abgebildet ist. Die Schwefellauge wird in einem
hohen Glasgefäſse mit 1g,5 Mangansuperoxyd auf
1l vermischt und Luft mittels eines einfachen
Dampfgebläses eingetrieben. Um das Verfahren zu einem continuirlichen zu machen,
wurde die Lauge vom Boden fortwährend durch einen Heber abgesaugt, dessen innerer
Schenkel in einen mit Baumwollzeug überspannten Trichter endete, während oben
fortwährend eine entsprechende Menge frischer Schwefellauge nachlief. Die
Entschweflung der Laugen ist nur vollständig, wenn man in sehr groſser Verdünnung
arbeitet, so daſs der Sulfid-Schwefel nur 0,1 Procent der Flüssigkeit ausmacht; dies
thut aber nichts, da man nicht einzudampfen hat und nur mit einem gröſseren Volumen,
also mit gröſseren Gefäſsen arbeiten muſs. Smith bekam
dabei ungefähr 70 Procent des Sulfid-Schwefels im Niederschlag, während der Rest als
Calciumhyposulfit fortging. Der Niederschlag am Boden des Gefäſses enthielt neben
Schwefel noch kohlensauren Kalk und das Manganoxyd. Smith berechnet, daſs man für jeden Acre (= 0ha,4) Sodahalden jährlich 537600 Gallonen (2435cbm) Drainage haben würde. Wenn diese auch so
stark als möglich wäre, so könnte man doch alle 12 Stunden 1200 Gallonen (54360
davon in einem Gefäſse von 1000 Gallonen (4530l)
Inhalt entschwefeln und würde dazu 224 Tage und Nächte brauchen. Das Ergebniſs
würde, nach dem längsten Versuche im Kleinen, 1,76 Procent oder 63,26 Tons (zu
1016k) sein, welche zum Preise von 120 M. für
1 Ton 7600 M. werth sein würden. Dies würde die Kosten sicher mehr als bezahlen,
aber nicht viel übrig lassen.
Aehnliche Resultate, wie mit dem Schwefelcalcium der Sodarückstände, erhielt Smith mit Schwefelbarium und gründet sogar hierauf den
Vorschlag, auf diesem Wege Aetzbaryt zu machen, um damit Natriumsulfat zu zersetzen.
Leider wird dieses Soda-Verfahren wohl an der Schwierigkeit der Beseitigung des
Bariumhyposulfits scheitern.
Verschiedene Versuche wurden auch gemacht, um den Schwefel der festen Sodarückstände
in vollständigerer Weise als bei Mond's Verfahren
auszuziehen; aber dies gelang nur mit Kraushaares
Verfahren (s.u.).
Auch in gröſserem Maſsstabe wurden Versuche mit der Smith'schen Methode durch Mactear in Glasgow
angestellt, freilich nicht mit sehr günstigem Erfolge. Hier wird nur das Endresultat
interessiren. Von 100 Theilen ursprünglich vorhandenen Sulfid-Schwefels wurden
wieder gefunden:
In Lösung (als Hyposulfit)
65,65 Th.
Im Niederschlag
33,18
Verlust
1,17
Im Niederschlag sind vorhanden:
als Schwefel selbst, also verwendbar
27,3 Th.
als Suffid
3,64
Smith glaubt dieses geringe
Ausbringen an Schwefel dadurch erklären zu können, daſs Mactear zu viel Luft angewendet habe, was man vermeiden müsse.
Von Wichtigkeit ist auch die Beobachtung von Smith, daſs
Schwefelcalcium und schwefelsaurer Kalk, welche unter gewöhnlichen Umständen so gut
wie gar nicht auf einander wirken, sich ganz anders verhalten, wenn man durch den
Brei einen anhaltenden Luftstrom bläst. Das Sulfat verschwindet ganz; ebenso findet
sich auch kein schwefligsaures Salz, sondern nur unterschwefligsaures Salz, indem
das Schwefelcalcium gleichfalls in dieses übergeht. Smith glaubt, daſs man auf diesem Wege nicht nur den Schwefel der bereits
oxydirten Sodarückstände, sondern auch den des natürlichen Gypses werde nutzbar
machen können, gibt aber zu, daſs ihm die Einzelheiten der Vorgänge noch nicht klar
seien und der Gegenstand weiterer Untersuchungen bedürfe, deren er auch mir sehr
werth zu sein scheint.
Smith bespricht ferner die bisher gebräuchlichen Schwefelregenerationsmethoden, von denen er aber nur
diejenige von Mond näher zu kennen scheint, welche die
einzige in England angewendete ist. Er constatirt, daſs dieser Proceſs (in England)
nur wenig angewendet wird und einen wenn auch nicht groſsen Gewinn lasse; die
Rückstände geben noch immer etwas, aber sehr wenig Schwefelwasserstoffgas aus, und
die Drainagen seien ganz frei von Sulfiden. Ueber das zu Dieuze angewendete
Verfahren (Smith erwähnt dabei gar nicht den
Patentträger, P. W. Hofmann, welchem doch wohl das
Hauptverdienst zukommt, sondern nur E. Kopp) gibt er
den, jetzt schon theilweise veralteten, Bericht von Rosenstiehl vollinhaltlich wieder. Ueber Schaffner's Verfahren, welches ihm augenscheinlich nicht näher bekannt
war, findet sich buchstäblich nur eine Zeile und kein
Wort über das neue Verfahren von Schaffner und Helbig.
Am interessantesten sind die Versuche, welche Smith
durch seinen Assistenten Curphey mit Kraushaar's Verfahren (vgl. 1877 226 412) anstellen lieſs. Dieses besteht darin, den Sodarückstand mit
Wasser unter einem Druck von 5at zu erhitzen. Curphey erhielt folgende Resultate:
Zeit des Erhitzens
Temperatur
Löslich gewordener Schwefel
5 Stunden
155°
86,0 Proc.
3
160
82,4
34
164
87,6
5
140
88,9
Smith (welcher Schaffner und
Helbig's Proceſs noch nicht kannte) meint, daſs durch Kraushaar's Verfahren der Schwefel der Sodarückstände
wohl am
vollständigsten zu gewinnen sei, daſs aber das Verfahren viel zu kostspielig sein
werde.
Endlich findet sich auch ein ausführlicher Bericht von Mactear über sein Verfahren zur Verwerthung der Drainage von alten
Sodahalden, wodurch zu St. Rollox jährlich 1500t
Schwefel gewonnen werden. Die ganzen Anlagekosten dafür beliefen sich auf 40000 M.;
die Selbstkosten des Schwefels werden zu 61 M. für 1t angegeben. Diese Berechnung ist übrigens eine ganz indirecte, nämlich
aus den Rohmaterialien der Sodafabrikation mit Abzug des Werthes des Sulfates, auf
einer mir unverständlichen Basis; es lohnt nicht näher darauf einzugehen, da der
wesentliche Zweck der ganzen Aufstellung ganz unverhohlen der ist, darzulegen, daſs
die Sodafabrikanten besser daran thäten, ihre Salzsäure zur Wiedergewinnung des
Schwefels nach Mactear's Verfahren zu verwenden, statt
Chlorkalk daraus zu machen. Dies hat meines Wissens bis jetzt noch keinem einzigen
englischen Sodafabrikanten so weit eingeleuchtet, daſs er Mactear's Patentlicenz erworben hätte. Wieweit Mactear Anspruch auf irgend welche eigene Erfindung in dieser Sache machen
kann, habe ich in meinem Handbuche der Soda-Industrie
aus einander gesetzt.
Während die erwähnten Verfahren sämmtlich den Zweck verfolgen, die Sodarückstände in
solcher Weise zu verarbeiten, daſs gar kein Schwefelwasserstoff entweichen kann,
wurde dieses Gas bei früheren Versuchen (z.B.
Gossage's) absichtlich erzeugt, um es zu verbrennen und Schwefelsäure daraus zu
machen. Ferner entsteht es noch jetzt massenhaft bei der Verarbeitung von
Schwefelammonium haltigem Gaswasser und gibt dabei oft eine Quelle groſser
Unannehmlichkeiten ab. Es sollte scheinen, als ob sich das hier frei werdende Gas
verhältniſsmäſsig leicht verbrennen lassen müſste, da es nicht mit Stickstoff
gemengt ist; dafür ist ihm aber stets viel Kohlensäure beigemengt, von dem stets
gleichzeitig im Gaswasser vorkommenden kohlensauren Ammoniak. Die Kohlensäure
bewirkt ein oftmaliges Ausgehen der Flamme des Schwefelwasserstoffes, welche
Schwierigkeit von W. Hunt dadurch überwunden worden
ist, daſs er die Gase durch ein Kokesfeuer streichen läſst. Die Koke brennt auf
einem Roste etwas über dem Boden des Kanales, durch welchen die gemischten Gase
streichen; auf jeder Seite befinden sich Oeffnungen, durch welche Luft zur
Verbrennung des Schwefelwasserstoffes eintreten kann, während die Luft zur
Verbrennung der Koke von unten kommt. Auf diese Weise wird das Gas fortwährend
entzündet gehalten, und das Gemisch von schwefliger Säure, Wasserdampf und
Kohlensäure wird in Bleikammern geleitet. Erst wird es aber durch einen 12m langen Kanal abgekühlt. Dieses Verfahren wurde
zuerst in der chemischen Fabrik zu Frizinghall bei Bradford eingerichtet, wo man
damit 4t Schwefelsäure wöchentlich erzeugt, dann
in Birmingham, wo man mehr fabricirt.
A. Smith ist der Meinung, daſs das Problem der
Verwandlung des Schwefelwasserstoffes in ein nützliches Product hiermit gelöst sei,
und man verlangen könne, daſs jede Belästigung aus dieser Quelle jetzt aufhören
solle. Dieser Schluſs scheint mir aber noch nicht durch die Thatsachen
gerechtfertigt, Smith selbst gesteht zu, daſs man
ziemlich viel Kokes braucht und daſs die Gase derselben die Condensation der Säure
sehr erschweren. Grade well alle darauf bezüglichen Angaben fehlen, bin ich der
Meinung, daſs bei diesem Verfahren wohl kaum die Kosten der Arbeit und des Salpeters
herauskommen werden, was bis dahin die allgemeine Erfahrung gewesen ist, wenn man
Schwefelwasserstoff auf Schwefelsäure zu verarbeiten gesucht hat. Eine Production
von 4t Schwefelsäure wöchentlich ist eine so
ungemein geringe, daſs schon daraus die Unmöglichkeit eines vortheilhaften
Kammerprocesses mit Sicherheit gefolgert werden kann. Bei der Zersetzung im
Gaswasser bekommt man übrigens noch lange nicht so verdünnten Schwefelwasserstoff,
als bei manchen anderen chemischen Processen, und in solchen Fällen wird Hunt's Verfahren erst recht nicht anzuwenden sein. Weit
eher glaube ich, daſs eine Beseitigung des Schwefelwasserstoffes und Verwerthung
seines Schwefels in vortheilhafter Weise nach dem Verfahren von Schaffner und Helbig
erreicht werden kann.
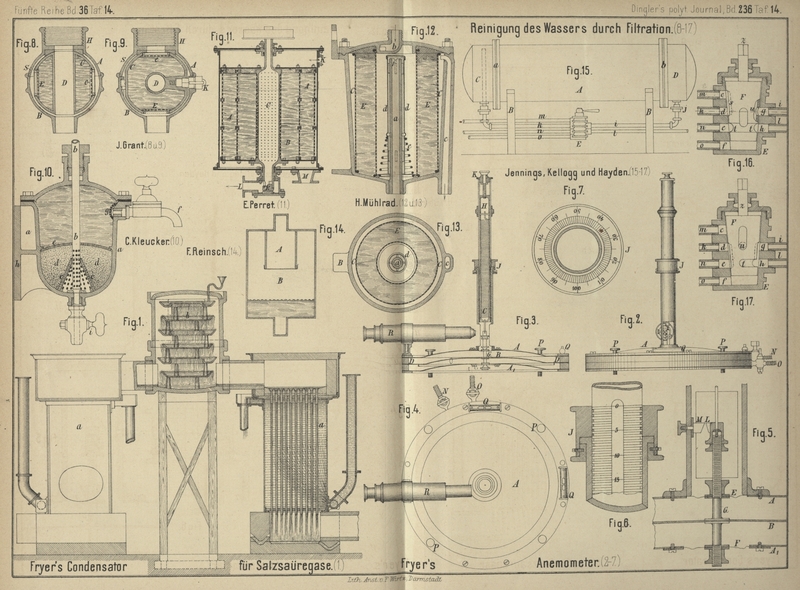
Wir wenden uns nun zu der Beschreibung neuer Condensationsapparate für Salzsäure. Von diesen hebt Smith besonders denjenigen von Fryer hervor, welcher in Figur 1 Taf.
14 abgebildet ist. Die Abkühlung der Gase, auf welche A.
Smith von jeher so viel Werth gelegt hat, ist hier in der möglichst
energischen Weise durchgeführt, nämlich in einem System von Glasröhren, welche von
kaltem Wasser umspült werden. Die Röhren sind 25mm
im Durchmesser und 1m,2 lang; je 144 davon sind in
einem Kasten a von 1m,2 Seite enthalten. Da aber später beim Zusammen treffen des Gases mit Wasser
wieder Wärme frei werden würde, so mischt Fryer das Gas
gleich mit so viel Wasserdampf, als zur Bildung gewöhnlicher Salzsäure nöthig ist,
und kühlt das Ganze nun in seinem Röhrenapparat ab. Auf dem kurzen Wege durch die
Röhren wird nun allerdings das Meiste verdichtet; aber es bleibt doch immer noch
etwas uncondensirtes Säuregas und zwar jetzt in sehr verdünnter Form übrig, welches
auch durch den Aufsatz b mit directer
Wassereinspritzung nicht verdichtet werden konnte. Der Versuch mit diesem Apparate,
welchen eine Fabrik in Widnes im groſsen Maſsstabe angestellt hatte, wurde aus
diesem Grunde sehr bald wieder aufgegeben, nach Smith's
Meinung zu früh, da ihm das Princip der energischen Röhrenkühlung das richtige
scheint. Ein Zusatzapparat, welchen Fryer mit
vorgeschlagen hatte, wurde gar nicht probirt; dies ist eine
„Staubstrahl-Kammer“, bestehend aus einem stehenden Cylinder mit sechs
horizontalen, in der Mitte durchbrochenen Scheidewänden; im Centrum rotirt eine Welle, auf welcher
Scheiben von etwas gröſserem Durchmesser als die Durchbrechungen sitzen; auf diese
fällt das Wasser auf, wird durch Centrifugalkraft herum gespritzt und läuft in der
Mitte nach der nächsten Etage ab. Vermuthlich würde dieser Apparat der Säure nicht
lange Widerstand geleistet haben.
Ein anderer Condensationsapparat, welcher jetzt grade in
derselben Fabrik probirt wird, ist der von Hazlehurst
(patentirt in England i. J. 1877, Nr. 1668). Er beruht darauf, daſs das saure Gas in
das Innere eines hohlen Cylinders gesaugt wird, welcher kolbenförmig in einem
anderen Gefäſse auf und ab geht, das mit Wasser oder verdünnter Säure gefüllt ist.
Beim Niedergange des Kolbens preſst er das Gas durch die Sperrflüssigkeit durch.
Was schlieſslich die Controle der
Condensation von sauren Gasen betrifft, so gibt Smith die Zeichnung und Beschreibung eines für ihn speciell construirten
Anemometers (von Fryer), welches in Fig. 2 bis
7 Taf. 14 wiedergegeben ist und das genaueste aller solchen Instrumente
sein soll. Es beruht darauf, den Luftdruck auf einer sehr groſsen Oberfläche
aufzunehmen und die Veränderung zu messen, welche dadurch an einer stählernen
Spiralfeder hervorgebracht wird. Fig. 2 ist
ein Aufriſs, Fig. 3 ein
Längsschnitt, Fig. 4 ein
Grundriſs, Fig. 5 ein
vergröſserter Schnitt desjenigen Theiles des Instrumentes, welcher unmittelbar unter
der Spiralfeder liegt, genommen im rechten Winkel zu Fig. 3. Fig.
6 ist ein vergröſserter Schnitt und Fig. 7 ein
Grundriſs der Schraubenmutter. Der untere Theil des Instrumentes besteht aus zwei
etwas gewölbten Kupferplatten A, A1
, zwischen welchen eine dritte Platte B an der Spiralfeder C
aufgehängt ist. Diese Platte B reicht nicht ganz bis an
die Wandung des die Platten einschlieſsenden Gefäſses; ein Diaphragma D aus dünnem Kautschukstoff oder aus dünnem, mit
Kautschuklösung getränktem Papier bewirkt einen luftdichten Abschluſs des Gefäſses
in eine obere und untere Kammer. Eine ähnliche Membran E gestattet dem Stift G, welcher die
Mittelscheibe trägt, eine kurze Strecke auf und ab zu gehen, und eine ganz ähnliche
Membran F schlieſst die Oeffnung in der unteren Scheibe
A1 ab. Die
Spiralfeder C hängt in einer Röhre H, welche durch Umdrehung der Schraubenmutter J gehoben oder gesenkt werden kann. Jede Umdrehung von
J hebt die Röhre um 1/10 engl. Zoll, und da ihre Oberseite in
100 Theile getheilt ist, so stellt jeder Theilstrich eine Verticalbewegung von 1/1000 Zoll (= 1/40mm) vor. Am oberen Ende des Instrumentes befindet
sich eine Stellschraube K, unter der Feder eine
Schneide L gegenüber einer anderen feststehenden
Schneide M. Die Röhren und Hähne N und O führen in die
obere bezieh. untere Kammer; Stellschrauben P und eine
Libelle Q dienen zur Horizontalstellung des
Instrumentes, ein Mikroskop R zur Beobachtung der
Schneiden M und L.
Die Benutzung des Instrumentes geschieht in folgender Weise: Kautschukröhren
verbinden die beiden Quellen verschiedenen Druckes mit den Hähnen N und O. Der
Druckunterschied wirkt nun auf die groſse Oberfläche der Scheibe B, welche dadurch herabgedrückt wird und die Feder
spannt. Man dreht nun die Mutter J so lange, bis die
Scheibe B wieder genau in der vorigen Stellung ist, was
man daraus erkennt, daſs die Schneiden L und M wieder einander genau gegenüber stehen. Die Anzahl
der Theilstriche an der Mutter J zeigt den gesuchten
Druck an. Man soll hierdurch einen Druck von 1/3000 Zoll (= 1/120mm) Aether mit
aller Leichtigkeit ablesen können. Man kann damit Luftgeschwindigkeiten bis hinab zu
3 Zoll (= 76mm) in der Secunde messen.
In dem Berichte von Smith sind noch
die Instructionen abgedruckt, welche eine von dem Vereine der englischen
Sodafabrikanten niedergesetzte Commission für die Controle des Entweichens von Gasen
aus den Schwefelsäurekammern und den Salzsäure-Condensatoren aufgestellt hat. Da ich
diese Regeln im Anhange zu meiner „Soda-Industrie“ (Bd. 2 S. 964 ff.)
ausführlich mittheile, so sei hier nur ein Auszug daraus gegeben.
Von den hinter den Gay-Lussac-Thürmen entweichenden Gasen soll eine Probe von etwa 1
Kubikfuſs stündlich je 24 Stunden hindurch continuirlich abgesaugt werden. Das Gas
wird durch vier Absorptionsflaschen von ganz bestimmtem Inhalt geleitet, von welchen
drei mit Normalnatronlauge, die vierte mit destillirtem Wasser gefüllt sind.
Temperatur und Barometerstand werden beobachtet und das Gasvolumen auf die
Normaleinheiten reducirt. Der Inhalt der Waschflaschen wird in drei Theile getheilt,
von denen der eine auf Gesammtsäure, der zweite auf Stickstoffsäuren titrirt wird
und der dritte als Reserve bleibt. Die Differenz zwischen der ersten und zweiten
Bestimmung wird als Säuren des Schwefels angenommen. Die Bestimmung der Gesammtsäure
geschieht durch Rücktitrirung der Natronlauge mit Normalschwefelsäure; das Resultat
wird in Gran Natriumcarbonat auf 1 Cubikfuſs ausgedrückt (während sonst in der
Anweisung nur metrisches Maſs und Gewicht angenommen ist!). Die Bestimmung der
Stickstoffsäuren erfolgt, indem die Absorptionslauge langsam in eine warme, stark
angesäuerte Halbnormal-Chamäleonlösung gegossen wird, so daſs noch ein kleiner
Ueberschuſs von Chamäleon bleibt, welcher durch einige Tropfen einer Lösung von
schwefliger Säure bis auf eine ganz schwache Rosafarbe weggenommen wird. Man bringt
die Flüssigkeit dann in eine saure Eisenvitriollösung, deren Verhältniſs zur
Chamäleonlösung bekannt ist, nachdem man aus dem sie enthaltenden Kolben die Luft
durch Kohlensäure verdrängt hat. Man kocht dann so lange, bis die dunkle Färbung von
Stickoxyd ganz verschwunden ist, und titrirt mit Chamäleon oder Bichromat zurück.
Durch Formeln erleichtert man sich die Ableitung der Werthe für Stickstoff und
für Schwefel im Cubikfuſs. Diese Anweisung, welche ganz im Einzelnen ausgeführt ist,
scheint mir in der That sehr zweckmäſsig zu sein; nur nimmt sie gar keine Rücksicht
auf Stickoxyd, welches doch notorisch gerade bei unregelmäſsigem Kammergange oft
entweicht. Wie man dieses und eventuell auch Stickoxydul bestimmen kann, habe ich in
meinem Handbuche S. 966 und 951 erörtert.
Die Vorschriften der englischen Commission für Controle des Entweichens von Salzsäure aus den Condensationsapparaten ähneln im
allgemeinen Theile ganz den obigen. Zur Absorption dient hier destillirtes Wasser,
und die Titrirung geschieht mit Silbernitrat und Kaliumchromat als Indicator; dabei
ist aber nicht beachtet, daſs dies bei Gegenwart von schwefliger Säure nicht ohne
weiteres angeht (vgl. Soda-Industrie, Bd. 2 S.
236).
Zürich, Februar 1880.
Tafeln