| Titel: | Zur Herstellung von Schwefelsäure. |
| Fundstelle: | Band 243, Jahrgang 1882, S. 55 |
| Download: | XML |
Zur Herstellung von Schwefelsäure.
Mit Abbildungen auf Tafel 6.
Zur Herstellung von Schwefelsäure.
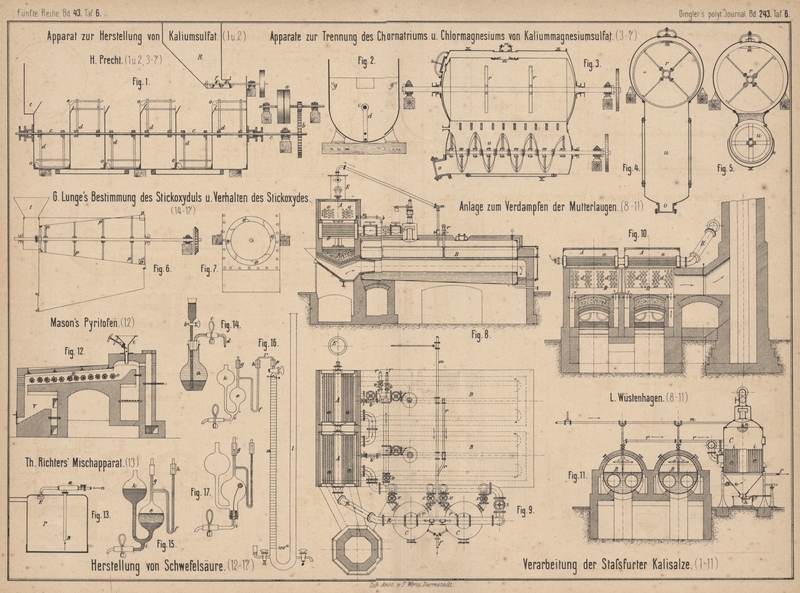
J. Mason in Eynham Hall (Englisches Patent Nr. 3196 vom
4. August 1880) verwendet bei seinem Pyritofen (Fig.
12 Taf. 6) einen langen geneigten Röstraum R,
in welchem eine Anzahl cannellirter Walzen von Eisen oder Thon durch ein auſserhalb des
Mauerwerkes liegendes Triebwerk langsam in Umdrehung versetzt werden. Die Kiese
werden durch eine kleine, ebenfalls gedrehte Walze im Fülltrichter t gleichmäſsig in den Röstraum eingestreut, von den
Walzen e langsam vorgeschoben, bis sie abgeröstet in
den Raum V fallen, um von dort nach Erfordern
ausgezogen zu werden.
Einen Apparat zum Mischen der Gase in
Schwefelsäurekammern empfiehlt Th. Richters in
Breslau (* D. R. P. Kl. 12 Nr. 15252 vom 11. Februar 1881), weil man nach seiner
Ansicht in einem gegebenen Kammerraum die Production von Schwefelsäure dadurch
steigern kann, daſs man für eine gründliche Durchmischung der Kammergase sorgt,
indem man dieselben unten aus der Kammer absaugt und oben wieder einbläst, oder
umgekehrt oben absaugt und unten wieder einbläst. Man bringt zu dem Zwecke auf der
Bleikammer P (Fig. 13
Taf. 6) einen Dampfstrahlapparat a an, welcher mittels
des von n aus eintretenden Wasserdampfes die Kammergase
unten bei B ansaugt und oben gegen die
Vertheilungsplatte E bläst.
Lasne und Benker (Comptes
rendus, 1881 Bd. 92 S. 191) glauben dadurch den Verlust an Stickoxyden bei der Schwefelsäurefabrikation auf ⅓ des
bisherigen verringern zu können, daſs sie die Bildung von Salpetrigsäure befördern.
Wegen des überschüssigen Sauerstoffes in den aus den Bleikammern entweichenden Gasen
sind hier die Stickoxyde vorwiegend als Untersalpetersäure vorhanden, welche von der
Schwefelsäure des Gay-Lussac-Thurmes bei weitem nicht so gut absorbirt werden als
die Salpetrigsäure. Die Bildung der letzteren wird nun dadurch erzielt, daſs man
unten in den Thurm eine passende Menge Schwefligsäure eintreten läſst. Dadurch soll
nicht nur ⅔ des früher gebrauchten Salpeters gespart werden; derselbe Bleikammerraum
soll auch eine erheblich gesteigerte Production zulassen.
G. Lunge bespricht in den Berichten der deutschen chemischen Gesellschaft, 1881 S. 2188 und 2196 die
Bestimmung des Stickoxyduls und das Verhalten des
Stickoxydes gegen Schwefligsäure. Er zeigt zunächst, daſs sämmtliche
Gasanalysen, bei denen es auf Stickoxydul abgesehen war, unbrauchbar sind, wenn
Alkalilauge, Eisenvitriollösung oder Schwefelsäure als Absorptionsmittel in irgend
gröſserer Menge zur Anwendung kamen. Wenn man z.B. erst Schwefligsäure, Kohlensäure
oder andere Säuren durch Natronlauge, Sauerstoff durch eine Auflösung von Pyrogallol
in Alkalilauge, dann Stickoxyd durch Eisenvitriollösung absorbirt, so muſs man, wenn
N2O vorhanden ist, eine ganz bedeutende Menge
davon mit fortnehmen, ja kann es wohl auf diesem Wege ganz entfernen und somit
völlig übersehen.
Wo gröſsere Mengen von N2O vorhanden sind, kann man
den einmal unvermeidlichen Fehler ganz bedeutend verringern, wenn man für die Säuren eine feste
Kalikugel, für Sauerstoff feuchten Phosphor oder eine Minimalmenge von Kalilauge mit
Pyrogallol gesättigt anwendet. Schlimmer steht es bei Anwesenheit von Stickoxyd. Lunge versuchte auch hier den Fehler zu vermindern,
indem er statt einer Lösung von Eisenvitriol eine mit solcher getränkte
Papiermachékugel nahm; aber die Resultate waren nicht brauchbar und es erscheint als
ein hoffnungsloses Unternehmen, eine genaue Analyse von derartigen Stickoxydul
haltigen Gasgemengen auszuführen. Um so schlimmer ist es, wenn die Menge des N2O jedenfalls sehr klein ist, wie etwa in
Bleikammergasen.
Bei der Verbrennung mit Wasserstoff oder Knallgas treten in Gegenwart von Stickoxydul
leicht unangenehme Nebenreactionen ein, welche die Resultate unbrauchbar machen. Man
hat auch empfohlen, das Stickoxydul durch Leiten über elektrisch glühenden
Palladiumdraht in Stickstoff und Sauerstoff zu spalten und durch die
Volumenvermehrung quantitativ zu bestimmen; aber auch mit diesem Verfahren konnte
Lunge keine annähernd richtigen Resultate erhalten.
Nach Winkler's Vorschlag (Gasanalyse, S. 429) soll man nach Absorption von salpetrigen Gasen und
Sauerstoff den Gasrückstand mit viel Wasserstoff' mengen und über schwach erhitzten
Palladium- oder Platinasbest leiten, wobei das Stickoxydul der Hauptsache nach in
Ammoniak übergeht und alkalimetrisch bestimmt werden kann. Es wurde bei angestellten
Versuchen aber immer nur ein kleiner Bruchtheil des vorhandenen N2O in Ammoniak übergeführt.
Lunge blieb zuletzt bei der Anwendung von absolutem
Alkohol zur Absorption des Stickoxyduls stehen. Zwar ist die Löslichkeit der meisten
indifferenten Gase in absolutem Alkohol nicht ganz unbedeutend, steht aber doch weit
hinter derjenigen des Stickoxyduls zurück. In der That kann man, wenn die meisten
anderen Gase entfernt sind, z.B. in einem Gemenge von Stickoxydul und Stickstoff,
die beiden Bestandtheile auf rein absorptiometrischem Wege (vgl. Bunsen: Gasometrische Methoden, 2. Aufl. S. 108)
bestimmen. Man kann für diesen Specialfall die allgemeine, von Bunsen gegebene Formel sehr vereinfachen, wenn
Temperatur und Luftdruck während des Versuches als constant angesehen werden können,
nämlich:
\frac{x}{x+y}=\frac{V-(V_1+\beta\,h)}{\alpha\,h-\beta\,h}\
\frac{V_1+\alpha\,h}{V},
wobei x das Volumen des N2O, y das Volumen des
Stickstoffes, α der Absorptionscoefficient von N2O in absolutem Alkohol bei der
Beobachtungstemperatur, β der von Stickstoff unter
denselben Umständen, V und V1 das Volumen des Gasgemenges vor bezieh.
nach dem Versuche, h die Menge des angewendeten
Alkohols in Cubikcentimeter bedeuten.
Um stets luftfreien Alkohol zu haben, bedient man sich des kleinen
Apparates Figur 14
Taf. 6. Ein sehr dickwandiger, etwa 200cc
fassender Kolben a trägt in seinem Kautschukstopfen einen gläsernen
Halmtrichter b, dessen Rohr bis an den Boden des
Kolbens reicht, sowie ein unter dem Stopfen endigendes Knierohr mit Quetschhahn c und ziemlich feiner Spitze d. Man füllt a fast ganz mit absolutem
Alkohol und läſst im Wasserbade einige Zeit lang bei offenem Quetschhahn c kochen. Wenn man sicher ist, alle Luft ausgetrieben
zu haben, gieſst man Quecksilber in den Trichter, schlieſst c, öffnet b und nimmt zugleich den Kolben aus
dem Wasserbad heraus. Während der Abkühlung flieſst Quecksilber ein, womit man den
Trichter von b stets gefüllt hält. Wenn alles kalt ist,
schlieſst man b und kann nun den Apparat beliebig lange
stehen lassen. Wenn man etwas von seinem Inhalte braucht, so öffnet man b, dann auf einen Augenblick auch c, so daſs etwas Weingeist aus der Spitze ausflieſst,
und führt nun letztere in den Apparat ein, in welchem man den luftfreien Alkohol
verwenden will. Durch Oeffnen von c und b, während der Trichter stets mit Quecksilber gefüllt
bleibt, kann man zu beliebigen Zeiten beliebige Mengen von Alkohol bis auf den
letzten Rest desselben auftreten lassen; zuletzt wird a
ganz mit Quecksilber angefüllt sein.
Zur Absorption des Stickoxyduls dient eine Gaspipette (Fig.
15 Taf. 6) deren Kugel e zur Aufnahme des
Gases und des Absorptionsmittels dient; sie wird mit dem Eudiometer (Fig. 16)
durch das Capillarrohr f und den Kautschukschlauch h verbunden. Die senkrechte Abzweigung g, für gewöhnlich durch ein Glasstäbchen verschlossen,
dient zum bequemen Einfüllen der Absorptionsflüssigkeiten. An dem weiteren
Verbindungsrohr zwischen den Kugeln e und k befindet sich die Abzweigung i mit Kautschukschlauch und Quetschhahn. Die Pipette wird zuerst durch k vollständig mit Quecksilber gefüllt, bis dieses aus
g und h überläuft;
dann wird das Glasstäbchen in h eingesteckt und in den
Schlauch von g die Spitze d des Alkoholapparates (Fig. 14)
eingeführt. Wenn man nun die Hähne b und c und zugleich i öffnet,
so strömt beliebig viel Alkohol in die Kugel e, während
Quecksilber bei i ausflieſst. Man zieht dann d heraus, verschliefst g
sofort durch ein Glasstäbchen und kann nun das Gas in die Pipette überführen. Wenn
man die Pipette mit Reagentien beschicken will, welche Berührung mit der Luft
vertragen, so füllt man sie mit Quecksilber, setzt auf g einen kleinen Trichter, füllt das Reagens ein und saugt es durch
Ausflieſsenlassen von Quecksilber aus i nach e hinein. Sollte aus Versehen etwas Luft mit eintreten,
so gieſst man Quecksilber in k ein, verdrängt so die
Luft aus e durch g und
verschliefst letzteres, sobald das Reagens auszuflieſsen beginnt.
Für die Absorption von Sauerstoff nimmt man am besten die Pipette
Fig. 17 Taf. 6. Man führt den Platindraht einer Kalikugel in das
Auslaufrohr i ein, welches eben durch den
Kautschukstopfen hindurchtritt, drückt letzteren fest ein, füllt die Pipette mit
Quecksilber und bringt in der eben beschriebenen Weise durch g eine ganz concentrirte Lösung von Pyrogallol in 0,5 bis 1cc Wasser ein, welche erst im Innern des Apparates
auf die Kalikugel einwirkt und sie theilweise auflöst. Das Ablassen von Quecksilber
aus i ermöglicht ein Uebersaugen des Gases durch das
Capillarrohr f, wenn der Druck im Schenkel l des Eudiometers dazu nicht mehr ausreicht, weil die
Reibung des Gases zu groſs ist, z.B. bei Benutzung mit Lauge oder bei theilweiser
Verstopfung der Capillare durch feste Ausscheidungen.
Bei dem Eudiometer Fig. 16 ist
unterhalb der Theilung des Schenkels m ein Glashahn n angebracht, dessen äuſseres Rohr ein wenig nach oben
gebogen und mit einem kurzen Stückchen Kautschukschlauch überzogen ist. Das
hierdurch gebildete Becherchen wird, nachdem das Eudiometer mit Quecksilber gefüllt
worden ist, durch augenblickliches Oeffnen von n zum
Ueberlaufen gefüllt. Dann läſst man durch o das
Quecksilber aus dem offenen Schenkel l auslaufen und
führt das capillare Leitungsrohr, aus welchem das einzuführende Gas schon ausströmt,
in den Kautschukbecher bei n ein, wobei ein wenig
Quecksilber herausgedrängt, aber keine Luft mit eingeführt wird. Wenn man nun bei
offenem Hahne o den Hahn n
behutsam öffnet, so steigt das Gas in dem Schenkel m
auf und wird wie gewöhnlich nach Gleichstellung des Quecksilberstandes gemessen.
Will man jetzt ein zweites und drittes Gas einführen, so füllt man das Becherchen bei n von neuem durch augenblickliches Oeffnen dieses
Hahnes und verfährt wie oben. Die Theilung des Schenkels m beginnt von dem Hahne p und umfaſst 100cc in Zehntel getheilt.
Das Eudiometer dient nur zum Messen und zum Entzünden von Gasmischungen durch die
oben eingeschmolzenen Platindrähte. Behufs aller anderen Reactionen werden die Gase
in Gaspipetten der oben beschriebenen Art übergeführt, wozu an der Spitze des
Schenkels m ein besonders sorgfältig gearbeiteter
Glashahn p mit capillarer Ausströmungsspitze angebracht
ist, auf welcher wiederum ein Kautschukbecherchen, mit Draht dicht verbunden,
steckt. Dieses wird mit Quecksilber gefüllt und das U-förmige Thermometerrohr r hineingedrückt, wobei sich letzteres ebenfalls mit
Quecksilber füllt. Ebenso wird der kleine Behälter h
erst mit Quecksilber gefüllt und, wenn man nun den anderen Schenkel von r hineindrückt, so ist eine luftfreie Verbindung
hergestellt, welche am besten durch Schlingen aus feinstem Eisendraht gesichert
wird. Nun führt man das Gas aus m in die vorher mit dem
anzuwendenden Reagens beschickte Pipettenkugel e über,
indem man Quecksilber in l eingieſst und nöthigenfalls
solches aus i abläſst, bis Quecksilber aus r, h und f in e eintropft. Die Wirkung des Reagens in e auf das Gas kann man durch Hin- und Herbewegen
steigern, was die Kautschukverbindungen gestatten, selbst wenn die Schenkel von r, wie es sein sollte, bei h und p Glas auf Glas stoſsen. Wenn man die
Einwirkung auf das Gas bei höherer Temperatur untersuchen will, so nimmt man die
Pipette vom Eudiometer ab, wobei das Gas durch das Quecksilber in f abgeschlossen ist, steckt ein Glasstäbchen in den
Becher h und setzt die Pipette in ein Luftbad o. dgl.
Um das Gas nach beendeter Reaction und nach dem Erkalten zu messen, füllt man h wieder mit Quecksilber auf und führt den freien
Schenkel von r ein, so daſs auch jetzt keine Luft
eintreten kann. Dann saugt man das Gas aus e nach m zurück, indem man p
öffnet und Quecksilber aus o ablaufen läſst, bei
gröſserem Reibungswiderstande auch solches in k
nachgieſst.
Hierbei ist freilich Folgendes zu beachten: Schon des genauen Ablesens wegen ist es
besser, wenn nichts von dem flüssigen Reagens in das Eudiometer kommt; ferner würde
dies jedesmal eine Reinigung desselben erforderlich machen und endlich kommt es oft
darauf an, daſs ein früher angewendetes Reagens sich nicht mit einem späteren
mische. Man öffnet daher besser beim Zurücksaugen des Gases den Hahn o nur wenig, damit das Gas nicht zu schnell
hinüberströmt und schlieſst p sofort, wenn die aus der
Pipette nachkommende Flüssigkeit bis an das Ende des horizontalen Theiles von r gekommen ist. Der Inhalt der kleinen Gassäule von
diesem Punkte bis an den Hahn p beträgt kaum 0cc,02 und ist somit ohne merklichen Fehler zu
vernachlässigen.
Bezüglich der Arbeit von R. Weber über die Einwirkung von Schwefligsäure auf Stickoxyd und salpetrige
Säure (vgl. 1867 184 246) sind neuerdings öfters, namentlich von Seiten
englischer Chemiker, Zweifel erhoben worden, ob Weber's
Resultate wirklich auf den Bleikammerproceſs anwendbar seien. Lunge hat nun mit Hilfe der vorhin beschriebenen
Apparate bezügliche Versuche ausgeführt, welche folgende Resultate ergaben:
Trockenes Stickoxyd und Schwefeldioxyd wirken nicht auf einander, weder bei
gewöhnlicher Temperatur, noch bei 100°, wenn Feuchtigkeit und Luft durchaus
ausgeschlossen sind. 32,1 Proc. NO und 69,9 Proc. SO2 mit 1cc Wasser bei 15°
zusammengebracht, ergaben sofort eine starke Reaction. Nach 2 Stunden waren nur noch
50 Proc. der Gase übrig, Dach 24 Stunden war die Reaction beinahe, nach 48 Stunden
völlig beendigt. 10 stündiges Erwärmen auf 60° brachte nur noch eine ganz
unbedeutende Contraction hervor. Alles Stickoxyd fand sich in Stickoxydul
umgewandelt, Stickstoff war nicht gebildet worden. Bei überschüssigem NO ergab sich
eine sehr erhebliche Reduction von Stickoxyd zu Oxydul.
Nach Weber sollte, wenn Schwefelsäure von vorn herein
gegenwärtig ist, keine Reduction von Stickoxyd zu Oxydul stattfinden. Es wurde daher
zunächst mit Schwefelsäure von 1,45 sp. G., also etwa der schwächsten in Bleikammern
normal vorkommenden, gearbeitet. 46cc,1 Gas,
enthaltend 71 Proc. NO und 29 Proc. SO2, wurden mit
2cc Schwefelsäure von 1,455 specifischem
Gewicht bei 14° zusammengebracht. Sofort trat, durch Auflösung von schwefliger Säure
in der Schwefelsäure, starke Contraction ein. Nach 24 Stunden wurde zuerst, nach 48
Stunden wiederum gemessen, aber ohne eine Veränderung zu finden. Der Gasrückstand,
erst mit einer Kalikugel behandelt, wurde von Eisenvitriollösung bis auf einen
höchst geringen, schon aus der vorherigen Analyse der verwendeten Gase zu
erklärenden Rückstand aufgenommen. Es war also bei dieser Temperatur in der That keine Reduction von NO zu N2O eingetreten; dasselbe war der Fall bei Erwärmung auf 55 bis 60° und
auch bei groſsem Ueberschuſs von schwefliger Säure und bei höherer Temperatur.
Diese Versuche beziehen sich nun aber noch nicht auf die normalen Verhältnisse eines
Schwefelsäure-Kammersystems, sondern nur auf solche, wo kein Sauerstoff vorhanden
ist, wie es nur selten eintreten kann. Wenn Sauerstoff vorhanden ist, so wird
zunächst das Stickoxyd in N2O3 oder N2O4 übergehen und es ist deren Wirkung auf
Schwefligsäure, welche in Frage kommt. Auſserdem kann es sich fragen, ob ein
weiterer Ueberschuſs von Sauerstoff, wie er ja in jeder normal arbeitenden
Bleikammer vorkommt, die Reaction nicht ebenfalls beeinfluſst. Zur Untersuchung
dieser Verhältnisse wurden zunächst Stickoxyd, Schwefligsäure, Sauerstoff und Wasser
zusammengebracht.
Bei allen Versuchen wurden etwa 24 bis 25 Vol.-Proc. Stickoxyd und so viel schweflige
Säure angewendet, daſs nach der Gleichung: 2SO2 +
2NO + 3O + 3H2O = 2H2SO4 + 2HNO2 noch ein Ueberschuſs von schwefliger Säure und Sauerstoff bleiben
muſste, von denen die erstere reducirend wirken konnte, wenn der letztere diese
Eigenschaft nicht aufhob. Auf 90 bis 100cc
Gasgemisch wurde je 2cc, einmal 4cc Wasser angewendet. Es wurde zuerst das NO im
Eudiometer abgemessen, in die vorher mit dem Wasser über Quecksilber beschickte
Pipette übergeführt, dann im Eudiometer erst SO2
abgemessen, darauf zu dieser Sauerstoff zugelassen, wieder gemessen und das Gemenge
von schwefliger Säure und Sauerstoff langsam in die Pipette hinübergedrückt, wo
sofort starke Erwärmung und Bildung von rothen Dämpfen mit sehr bedeutender
Volumcontraction eintrat; die rothen Dämpfe erblaſsten nach kurzer Zeit. Ganz
dieselben Resultate erhielt man durch die Abänderung, daſs zuerst ein Gemenge von
schwefliger Säure und Sauerstoff hergestellt und in die Pipette eingelassen wurde,
wo natürlich durch Absorption der schwefligen Säure durch das Wasser bedeutende
Contraction eintrat, worauf dann allmählich NO zugelassen wurde. In allen Fällen
zeigte sich eine deutliche, aber geringe Bildung von
Stickoxydul. Auf etwa 25 Proc. NO wurde in den verschiedenen Versuchen 1,3 bis 5,6
Proc. N2O gebildet. Auſserdem blieb stets ein
Gasrückstand von 1,2 bis 3 Proc., abgesehen von der aus der vorgängigen Analyse der
Gase berechneten Menge Stickstoff. Ein Verbrennungsversuch mit Wasserstoff zeigte
die Anwesenheit von Kohlenoxyd, wie sie nach der Anwendung von Pyrogallol zu
vermuthen war.
Wenn damit auch nicht sicher die Reduction von Stickoxyd bis zu Stickstoff
nachgewiesen ist, so scheint doch jedenfalls nach diesen Versuchen auch bei
Ueberschuſs von Sauerstoff eine Reduction unterhalb NO einzutreten, wenn man bei
Gegenwart von Wasser arbeitet, was für den Schwefelsäure-Kammerproceſs sehr wichtig
ist.
Bei Anwendung von Stickstoff, Schwefligsäure, Sauerstoff und Schwefelsäure von 1,32
sp. G. zeigte sich keine merkliche Menge von Stickoxydul und kein Stickstoff.
Tafeln