| Titel: | Apparate für chemische Laboratorien. |
| Fundstelle: | Band 248, Jahrgang 1883, S. 370 |
| Download: | XML |
Apparate für chemische Laboratorien.
Mit Abbildungen auf Tafel 25.
Apparate für chemische Laboratorien.
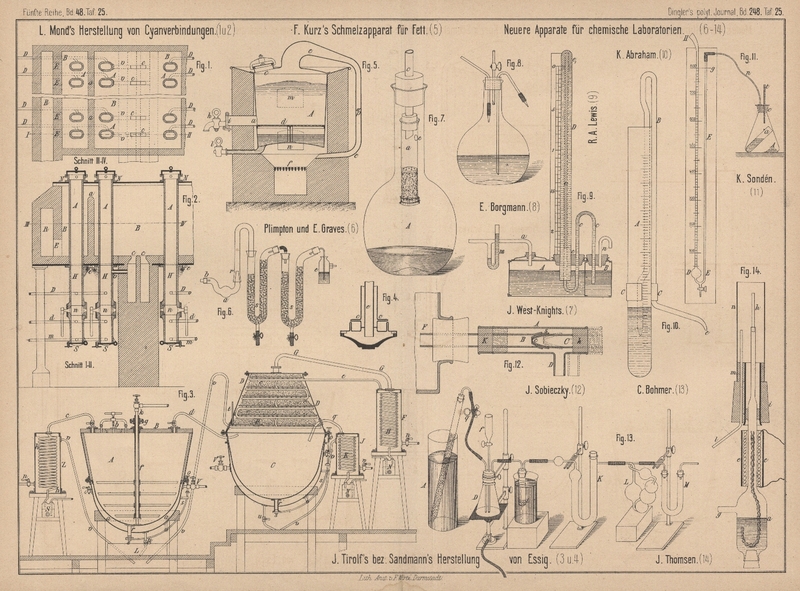
Der Extractionsapparat von J.
West-Knights besteht nach dem Analyst, 1883 S.
65 im Wesentlichen aus einem cylindrischen Glasgefäſse a (Fig. 7 Taf.
25), welches unten mit feinem Battist überbunden ist, darüber eine Scheibe Filtrirpapier oder
Glaswolle enthält, dann die zu extrahirenden Stoffe, bedeckt mit einem Siebboden.
Beim Gebrauche treten die in der Flasche A entwickelten
Dämpfe von Aether, Alkohol u. dgl. durch die seitliche Oeffnung e in den Extractionscylinder a, verdichten sich in dem damit verbundenen Kühlrohre c, das Lösungsmittel tropft auf den Siebboden, laugt
die zu untersuchende Probe aus und flieſst in die Flasche zurück. – Der Apparat
zeichnet sich dadurch aus, daſs die Auslaugung bei einer dem Siedepunkte der
Extractionsflüssigkeit nahen Temperatur erfolgt.
R. A. Lewis (Chemical News, 1883 Bd. 47 * S. 56) hat das
Ramsbottom'sche Differential-Anemometer (1866 180 * 334)
verbessert. Das oben zugeschmolzene Rohr D (Fig.
9 Taf. 25) enthält etwas roth gefärbtes Benzin, sonst aber, wie auch die
beiden Gefäſse A und B
Wasser. Sobald nun auf das Wasser im Behälter A durch
Rohr a ein Druck ausgeübt wird, muſs das Benzin in dem
Rohre c niedergedrückt werden und zwar derartig, daſs
die Benzinsäule ee1
7mal so lang ist als die dem zu messenden Gasdrucke entsprechende Wassersäule des
kleinen Druckmessers m. Löst man in dem Benzin Paraffin
auf bis zu 0,95 sp. G., so erhält man nach der Formel 1 : (1 – 0,95) = 20 eine 20
fache Vergröſserung des Druckunterschiedes in A und B. Soll der Apparat als Zugmesser verwendet werden, so verbindet man das Rohr n mit dem betreffenden Räume, während Rohr a mit der atmosphärischen Luft in Verbindung steht.
(Vgl. F. Fischer 1882 244 *
207. Seger und Aron 1883
246 * 507).
J. Taylor empfiehlt (Daselbst * S. 145) zur Herstellung von Schwefelwasserstoff, Leuchtgas durch
siedenden Schwefel zu leiten, wobei sich fast der gesammte Wasserstoff des
Leuchtgases zu Schwefelwasserstoff verbinden soll, während die übrigen
Bestandtheile, Methan, Kohlenoxyd u. dgl., unverändert entweichen sollen. – Das
gewöhnliche Verfahren mit Schwefeleisen und Säure dürfte doch einfacher sein.
C. H. Stearn (Daselbst S. 54) bringt zur Beleuchtung von Mikroskopen die Swan'sche Glühlampe in Vorschlag, unter Verwendung einer Leclanche'schen Batterie oder von Accumulatoren. – Grubl (Engineering, 1883 Bd. 35 S. 216) empfiehlt
dieselbe Beleuchtung für die Meſsvorrichtungen der Teleskope.
Die in Fig. 8 Taf. 25 nach der Zeitschrift für
analytische Chemie, 1883 S. 60 abgebildete Spritzflasche für heiſses Wasser von E.
Borgmann hat einen 3 fach durchbohrten Gummistopfen. In der einen Oeffnung
befindet sich ein gewöhnliches Steigrohr, in der zweiten das Einblaserohr; letzteres
ist an seinem im Inneren der Flasche befindlichen Ende etwas erweitert und mit einem
Bunsen'schen Kautschukventile versehen, das sich
nur nach der Flasche zu öffnet. In der dritten Oeffnung befindet sich ein gläserner
Durchlaſshahn, dessen untere, bis in den Flaschenhals reichende Ansatzröhre schief
abgeschliffen ist. Während man das Wasser erhitzt, läſst man den Glashahn offen, so
daſs das Einblaserohr kalt bleibt.
J. Sobieczky (Daselbst S. 229) empfiehlt als Hahn für Standflaschen, Aspiratoren u. dgl. die in Fig.
12 Taf. 25 skizzirte, aus 3 Glasröhren A, B
und C bestehende Vorrichtung. Die etwa 18mm weite Röhre A ist
mit seitlichem Abfluſsrohre D versehen, Rohr C ist bei c kegelförmig
zugeschmolzen und mit Kautschukschlauch s überzogen.
Kork K läſst sich auf Rohr B verschieben, während C durch Kork k fest mit A verbunden
ist. Will man nun z.B. aus der Flasche F Wasser
ablassen, so zieht man die mit A verbundene Vorrichtung
nach rechts in die punktirte Stellung, so daſs durch Ansatz D der Abfluſs stattfinden kann.
Zur Bestimmung der Verbrennungswärme flüchtiger organischer
Verbindungen empfiehlt J. Thomsen in den Berichten der deutschen chemischen Gesellschaft, 1882
S. 2996 und 3001 dieselben, wenn sie schwer verbrennbar sind, im Wasserstoffstrome
zu verdampfen und das Gasgemisch im Calorimeter mittels Sauerstoff zu verbrennen.
Die zu verbrennende Flüssigkeit befindet sich in dem 2cm weiten Glasbehälter a (Fig. 14
Taf. 25). Wird nun durch die von einem Glasrohre eingeschlossene Platinspirale e ein elektrischer Strom geleitet, so kann die
Temperatur der im Dochte aufsteigenden Flüssigkeit so gesteigert werden, daſs ein
durch Rohr g eingeführter Strom Wasserstoff mit den
Dämpfen derselben beladen aus der von Platin hergestellten Brennermündung h heraustritt. Statt Wasserstoff kann unter Umständen
auch Stickstoff oder atmosphärische Luft verwendet werden. Der in das Calorimeter
eingesetzte Kautschukstopfen i trägt seitlich das Rohr
l, durch welches der für die Verbrennung nöthige
Sauerstoff in den Verbrennungsraum des Calorimeters hineintritt. Die Fortsetzung des
Kautschukstöpsels bildet ein durchbohrter Korkcylinder m von etwas geringerem Durchschnitte, der zur Befestigung einer Röhre n von dünnem Platinbleche dientletztere umschlieſst die
beiden Röhren, welche Sauerstoff und Wasserstoff liefern, und bezweckt eine
möglichst vollständige Ausnutzung des Sauerstoffes zu erzielen.
Wenn nach den mitgetheilten Versuchen 1 Mol. Kohlenstofftetrachlorid aus amorphem
Kohlenstoff (dessen Verbrennungswärme gleich 96960c angenommen wird) und gasförmigem Chlor gebildet und das Product als
Dampf von normaler Dichte bei 19° angenommen wird, so ist der Prozeſs von einer
Wärmeentwickelung von 21030c begleitet, Für
flüssiges Kohlenstofftetrachlorid würde die Bildungswärme dagegen etwa 28320c betragen. Die Bildungswärme der gasförmigen
Producte bei constantem Druck aus amorphem Kohlenstoff beträgt somit für C + Cl4 = 21030c, für C
+ H4 = 21750c und
für C + O = 29000c. Diese Zahlen drücken aber
nicht die wahre Affinität zwischen Kohlenstoff und den fraglichen Elementen aus, da
die Dissociation des Kohlenstoffmoleküls und die Vergasung desselben eine so
beträchtliche Arbeitsmenge erfordert, daſs dadurch die beobachtete, Wärmentwickelung
um etwa 38380c für jedes Kohlenstoffatom geringer
wird als diejenige, welche der Reaction des gasförmigen Kohlenstoffes entsprechen
würde; dieselbe würde für die 3 Reactionen 59410, 60130 und 67380c entsprechen. Die Bildungswärme von Aethylen
beträgt für C2 + H4
= – 2710c, von Perchloräthylen für C2 + Cl4 = – 1150c. Werden dieselben durch Zutritt von Wasserstoff
oder Chlor in Methan bezieh. Perchlormethan gespalten, so ergeben sich: 2(C + H4) – (C2 + H4) = 43500 + 2710c
= 46210c bez. 2(C + Cl4) – (C2 + Cl4) = 42060 + 1150c = 43210c.
Unter Bezugnahme des wahrscheinlichen Werthes der doppelten Bindung der
Kohlenstoffatome 14130c wird also die Affinität
eines Atomes Wasserstoff bezieh. Chlor zum Kohlenstoff 15080c und 14330c
betragen.
Zur Bestimmung der Halogene in flüchtigen organischen
Stoffen bringen R. T. Plimpton und E. E. Graves (Journal of the Chemical Society, 1883 S.
119) die abgewogene Probe in das aus schwer schmelzbarem Glase hergestellte
Kugelrohr a (Fig. 6 Taf.
25), in welches bei b in der beim Bunsen'schen Brenner üblichen Weise Leuchtgas und Luft
eingeführt wird, so daſs man nach dem Anzünden des Gasgemisches bei r eine etwa 2cm lange
Flamme erhält. Die Absorptionsrohre s sind mit kleinen
Glaskugeln gefüllt und enthalten etwas Natronlauge; die mit einem Sauggebläse
verbundene Flasche e enthält eine Lösung von
salpetersaurem Silber, um zu erkennen, ob die Absorption in den Röhren s vollständig ist. Während der Verbrennung wird das
Rohr a passend erwärmt. Ist die Probe verflüchtigt und
verbrannt, so werden die Rohre s ausgespült, um das
gebildete Chlor-, Brom- oder Jodnatrium in bekannter Weise zu bestimmen.
Zur Bestimmung der Salpetersäure empfiehlt C. Böhmer in der Zeitschrift
für analytische Chemie, 1883 S. 20, dieselbe in Stickoxyd überzuführen und
dieses durch eine Lösung von 10g Chromsäure in 10
bis 15cc einer 12procentigen Salpetersäure
absorbirt zu wiegen. Zur Kohlensäureentwickelung verwendet er einen mit verdünnter
Salzsäure gefüllten Cylinder A (Fig. 13
Taf. 25), in welcher ein unten zur Spitze ausgezogenes, mit Marmorstücken gefülltes
Rohr steht. Man bringt nun die zu untersuchende Probe in die Kochflasche D und öffnet den Quetschhahn q, um die Luft in dem Apparate durch Kohlensäure zu verdrängen. Hierauf
läſst man durch den Scheidetrichter f Eisenchlorür und
sehr starke Salzsäure einflieſsen, stellt die Kohlensäure bis auf ein geringes ab
und erwärmt die Flüssigkeit langsam bis zum Kochen. Das entwickelte Stickoxyd geht
zunächst durch das Reagensrohr i, welches etwa 0g,5 mit wenig Wasser übergossenes kohlensaures
Natrium enthält, um mitgerissene Salzsäure zurückzuhalten, dann durch das
Chlorcalciumrohr K, so daſs es völlig wasserfrei in die
Chromsäurelösung des Kugelapparates L tritt. Ist alles
Stickoxyd ausgetrieben, so leitet man kurze Zeit einen langsamen Strom Kohlensäure
hindurch, zieht den Apparat zwischen i und K aus einander, saugt mit Hilfe eines an das
Chlorcalciumrohr M angesetzten Gummischlauches Luft
hindurch und wägt L und M.
Da 1 Mol. Stickoxyd 1
Mol. Salpetersäure entspricht, so kann man aus der Gewichtszunahme die Salpetersäure
berechnen.
K. Sondén (Daselbst S. 23) schlägt vor, bei der Bestimmung von Kohlensäure, Stickstoff u. dgl. die
Menge des entwickelten Gases aus dem Drucke bei constantem Volumen zu berechnen. Zu
diesem Zwecke verwendet er ein Entwickelungsgefäſs A
(Fig. 11 Taf. 25) aus starkem Glase mit gut eingeschliffenem
Messingstopfen e und eingekittetem Thermometer t. Das Capillarrohr n ist
aus Kupfer oder Blei hergestellt. Als Sperrflüssigkeit in dem Manometer EDH wird Quecksilber oder Wasser angewendet.
Bei der Bestimmung von Kohlensäure bringt man z.B. 0g,5 der zu untersuchenden Probe in das Entwickelungsgefäſs A, stellt das Röhrchen a
mit 10cc Salzsäure dabei und setzt den etwas
eingefetteten Stopfen e ein. Nun füllt man bei H Quecksilber ein, bis die Kugel etwa halb voll ist;
die Luft wird jetzt so weit ausgesaugt, wie es mit dem Munde ausführbar ist. Das
Quecksilber steigt dann beim Zulassen der Luft ein Stück in E zurück. Nachdem sich die Temperatur ausgeglichen hat, bringt man durch
Eingieſsen von mehr Quecksilber die Säule in E bis an
die Marke g. Der Stand des Quecksilbers in DH wird abgelesen und notirt. Man läſst nun die
Säure auf die Probe herausflieſsen, wobei das Quecksilber in E sinkt und in DH steigt. Wiederum
gieſst man Quecksilber ein, bis die Marke g erreicht
ist. Eine zweite Ablesung an der Skala zeigt die Zunahme des Druckes durch die
Entwickelung der Kohlensäure.
Weil hier der Druck durch eine Differenzablesung ermitteltermitttelt wird, so braucht man weder die Spannung des Wasser- oder Säuredampfes,
noch die Capillardepression des Quecksilbers oder den Barometerstand in Betracht zu
ziehen. Ist G das absolute Gewicht des Gases, V das corrigirte Volumen des Entwickelungsgefäſses
(wobei man auch das Volumen der Säure und des Proberöhrchens zu beachten hat), S das Gewicht von 1cc
des Gases bei 0° und 760mm, P die Zunahme des Druckes in mm Quecksilbersäule, t die Temperatur, so ist
G=\frac{VPS}{760\,(1+0,00366\,t)}. Für dasselbe Gas und
denselben Apparat kann die Zahl VS:760, durch Anwendung immer
derselben Säuremenge, constant gemacht und also ein für alle Mal ausgerechnet
werden.
In entsprechender Weise soll der mit bromirter Lauge entwickelte Stickstoff bestimmt
werden.
K. Abraham (Daselbst S. 28) empfiehlt als Bürette für Flüssigkeiten, welche Kautschuk angreifen,
einen mit Cubikcentimetertheilung versehenen Cylinder A
(Fig. 10 Taf. 25), an welchem sich mittels Klammer C das an beiden Enden zur Spitze ausgezogene enge Heberrohr B verschieben läſst. Ist der Heber mit Flüssigkeit
gefüllt und sein innerer Arm in dieselbe getaucht, so flieſst sie bei e aus und zwar je nach der Tiefe des Eintauchens
entweder in Form eines Strahles, oder in Tropfen. Hebt man den Heber aus der
Flüssigkeit, so hört das Abflieſsen auf, ohne daſs man eine Selbstentleerung des
Hebers zu befürchten hat.
Tafeln