| Titel: | Ueber die elektrolytische Gewinnung von Metallen und Chlor; von Ferd. Fischer. |
| Autor: | Ferd. Fischer |
| Fundstelle: | Band 256, Jahrgang 1885, S. 27 |
| Download: | XML |
Ueber die elektrolytische Gewinnung von Metallen
und Chlor; von Ferd.
Fischer.
Mit Abbildungen auf Tafel
3.
F. Fischer, über die elektrolytische Gewinnung von
Metallen.
C.
Höpfner in Berlin (* D. R. P. Kl. 12 Nr. 30222 vom 8. April 1884) behauptet, bei
der Elektrolyse von Halogensalzen der Leicht- und
Schwermetalle seien die durch die Polarisation begründeten Schwierigkeiten
einer vortheilhaften Anwendung der Elektricität in der chemischen Groſsindustrie
bisher hinderlich gewesen. Er will nun eine Polarisation durch Benutzung
depolarisirender Stoffe an der Kathode bezieh. durch Bewegung der Elektrolyte
beseitigen, wodurch es gelingen soll, in vortheilhafter Weise Chloride zu zersetzen
und das hierbei auftretende Chlor in mannigfachster Weise nutzbar zu machen.
Um z.B. Chlor auf unmittelbarem Wege elektrolytisch aus einem beliebigen Chloride,
z.B. Kochsalz, darzustellen, verwendet man nach seiner Angabe in der Lösung des
Chlorides als Anode irgend eine durch Chlor nicht angreifbare, leitende Substanz, wie Kohle oder
Braunstein u. dgl., und läſst an ihr die Chloridlösung ununterbrochen zu- und
abflieſsen, wodurch das frei werdende Chlor fortgeführt wird. Die polarisirende und
den Strom schwächende Ausscheidung von Wasserstoff an der Kathode soll dadurch
vermieden werden, daſs die letztere, welche aus Blei, Kupfer, Eisen, Kohle oder
anderem leichten Materiale bestehen kann, von einer Substanz umgeben bezieh. bedeckt
wird, welche die Polarisation verhindert, z.B. Salpetersäure, Mangansäure,
Chromsäure und die Lösungen ihrer Salze, Lösungen der Oxydsalze des Eisens, Mangans,
Quecksilbers u. dgl., oder solcher Salze, welche Metalle abscheiden, z.B.
Goldchlorid, Kupfersulfat und Natriumplumbat u.a. Mit besonderem Vortheile soll die
Depolarisation der Kathode aber auch durch in Wasser unlösliche Stoffe erfolgen,
welche durch Alkalimetall bezieh. Wasserstoff reducirbar sind, z.B. Chloride,
Sulfate, kohlensaure und andere Salze schwerer Metalle, ferner Sulfide, wie
Bleiglanz oder Schwefelkies u. dgl., endlich hauptsächlich die Oxyde der schweren
Metalle, Zinkoxyd, Kupferoxyd, Zinnstein, Magneteisen u.a., besonders aber
Bleisuperoxyd oder Mennige. Bei Benutzung fester Depolarisationsmittel dient als
elektrolytische Flüssigkeit der Kathode eine Kochsalzlösung oder die Lösung eines
anderen Chlorides.
Bei Ausführung des Verfahrens stehen die Elektroden senkrecht neben bezieh. in
einander, oder sie werden über einander angebracht. Die Kathode mit ihrer
Mennigebedeckung liegt dann unterhalb der Chlor entwickelnden Anode.
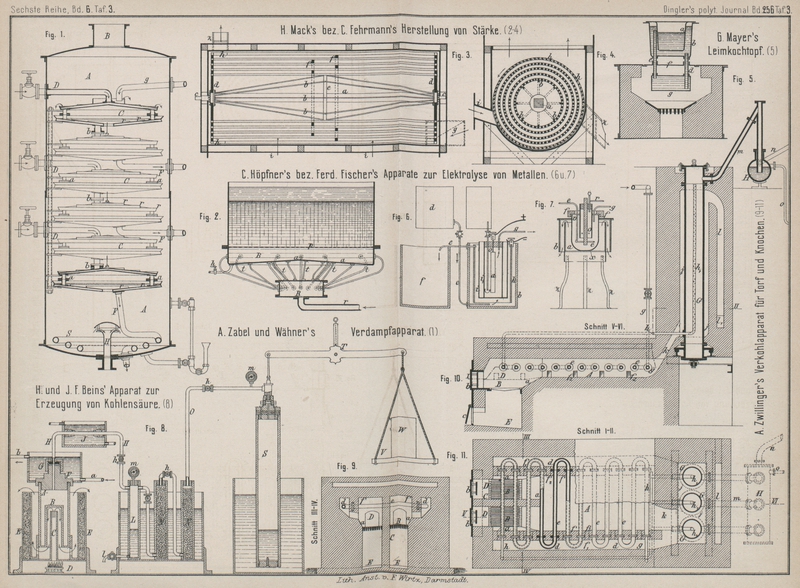
In Fig. 6 Taf.
3 steht die hohlcylinderförmige Kathode k in einem
Behälter b, in welchem eine Doppelmembran i i1 mit der Anode a sich befindet. Der Elektrolyt der Kathode tritt
mittels Rohr c aus dem Behälter d in den unteren Theil des Behälters b ein,
steigt nach oben und verläſst in reducirtem Zustande den Apparat durch Rohr e,
welches die Flüssigkeit zum Gefäſse f leitet. Die Anode
a wird von der mit Chlor zu sättigenden oder zu
chlorirenden Flüssigkeit umspült, indem die letztere durch Rohr o zu- und durch Rohr g
abgeleitet wird.
Je nach der angewendeten Depolarisationssubstanz bildet sich an der Kathode entweder
ein Natriumsalz, kohlensaures Natron bei Anwendung von kohlensaurem Blei,
phosphorsaures Natron bei Anwendung von phosphorsaurem Blei, oder es bildet sich bei
Anwendung von Sulfiden und Oxyden Natriumhydroxyd bezieh. Natriumhydrosulfid. Diese
können von Zeit zu Zeit abgelassen und zu den verschiedensten Zwecken verwendet
werden. Von besonderer Wichtigkeit soll die unmittelbare Gewinnung von Natronlauge
sein, welche bei genügender Vorsicht angeblich in reinem Zustande erzeugt werden
kann. Diejenigen Theile des Apparates, welche mit der alkalischen Lauge der Kathode
in Berührung kommen, werden zweckmäſsig aus Eisen oder anderem widerstandsfähigen
Materiale hergestellt; diejenigen Theile dagegen, an denen freies Chlor auftritt, müssen aus
möglichst feuerfestem Materiale bestehen. Die Membranen werden aus porös gebranntem
Thon, Asbest, Schlackenwolle, Pergamentpapier oder anderem gegen Säuren oder
Alkalien widerstandsfähigen Materiale hergestellt. Statt freies Chlor zu erzeugen,
kann man auch eine Oxydation oder Chlorirung dadurch erzielen, daſs mit der
Chloridlauge die zu chlorirende Substanz an der Anode langsam vorüber geführt wird.
In dieser Weise soll es möglich sein, Chlorsauerstoffsalze dadurch herzustellen,
daſs der Kochsalzlauge an der Anode Alkalihydrat zugeführt wird; ferner wird es
ermöglicht, das für die Extraction von Metallen wichtige Eisenchlorid aus dem
Chlorüre zu bilden; endlich können in dieser Weise auch organische Substanzen, wie
Alkohol, chlorirt werden.
In dieser Weise soll es auch möglich sein, Eisenchlorür enthaltende Abfalllaugen
sowie Manganchlorür, Chlorcalcium u. dgl. zu verwerthen, Jod aus Jodiden, Brom aus
Bromiden, Aetzkali aus Chlorkalium zu gewinnen u.s.w. –
Entsprechende Vorschläge zur Gewinnung von Alkalien und Chlor wurden bereits von Wastchuk (1881 239 * 54) und
Wollheim (1882 245 *
511) gemacht, bis jetzt ohne praktische Erfolge, weil offenbar in dieser Weise reine
Alkalilaugen nicht zu erhalten sind. In wie weit das entwickelte Chlor die Kosten
decken kann, ergibt sich aus der Erwägung, daſs man für Pferdestärke und Stunde
nicht mehr als 3 Grammäquivalente wird zersetzen können, somit 106g,5 Chlor erzielen würde (vgl. 1884 251 29). Die
von Höpfner vorgeschlagenen depolarisirenden Stoffe
können die Sache nicht vortheilhafter gestalten, da für jedes Aequivalent frei
gewordenes Chlor z.B. auch dem verwendeten Braunsteine 1 Aeq. Sauerstoff entzogen
wird, d.h. es ist ebenso viel Braunstem erforderlich,
als wenn man denselben unmittelbar mit Salzsäure
behandelt, ohne Mitwirkung des Stromes.
Nach einem ferneren Vorschlage Höpfner's (D. R. P. Kl.
40 Nr. 30414 vom 21. März 1884) soll zu Gewinnung von
metallischem Natrium Kochsalz in einem Tiegel geschmolzen werden, auf
dessen Boden sich eine Schicht Kupfer oder Silber befindet. Die Seitenwände des
Tiegels bestehen aus nicht leitendem Material. Die Metallschicht am Boden des
Tiegels soll als Anode dienen und wird deshalb durch einen von unten oder von der
Seite eingeführten Eisen- oder Kupferdraht mit dem entsprechenden Pole der
galvanischen Batterie oder Dynamomaschine in Verbindung gesetzt. Wird nun der Strom
dadurch geschlossen, daſs die aus Kohle oder einem Metalle bestehende Kathode in das
geschmolzene Chlorid von oben eingetaucht wird, so beginnt eine lebhafte Abscheidung
von metallischem Natrium. Während sich hier das leichte Metall oben abscheidet, geht
das Chlor nach unten zum Metalle und bildet Chlorid, welches bei der hohen
Temperatur schmilzt und bei andauerndem Strom die elektrolytische Flüssigkeit der
Anode darstellt. Ebenso wie das Natrium sollen auch andere Alkalien und Erdmetalle, z.B. Magnesium und
Aluminium, aus den Chloriden und sonstigen schmelzbaren Verbindungen derselben
dargestellt werden. –
Auch dieses Verfahren verspricht keinen Vortheil, da für je 23 Th. Natrium 63,5 oder
31,75 Th. Kupfer, je nachdem Cu2Cl2 oder CuCl2
gebildet wird, oder aber 107 Th. Silber erforderlich sind. Damit ist die
Depolarisation, d.h. der geringere Stromverbrauch denn doch zu theuer bezahlt (vgl.
1884 251 422).
J. Rogers in Milwaukee (Nordamerikanisches Patent Nr.
296357) will zur Herstellung der Alkalimetalle die
Chloride in einem Tiegel schmelzen, woraus dieselben durch ein mit Hahn versehenes
Rohr in das Zersetzungsgefäſs flieſsen sollen, aus welchem Chlor und Metalldämpfe
getrennt entweichen, nachdem die Luft durch ein indifferentes Gas verdrängt ist
(vgl. 1882 246 28). –
Diese Ueberführung des geschmolzenen Chlornatriums durch das mit Hahn versehene
Verbindungsrohr halte ich für ganz undurchführbar.
Im Frühjahre 1884 habe ich weitere Versuche über die Herstellung und Verwendung von Magnesium aus Carnallit durch Elektrolyse
ausgeführt (vgl. 1882 246 * 28. 1884 253 34). Um den allmählich zur Hellrothglut
gebrachten Porzellantiegel (aus der kgl. Porzellan-Manufactur in Berlin) möglichst
gleichmäſsig zu erhitzen, benutzte ich zwei aus Eisenblech hergestellte, innen mit
Asbestpappe ausgekleidete, 13 und 17cm weite Ringe
a und b (Fig. 7 Taf. 3),
welche unten durch 3 starke Drähte verbunden waren und auf 3 Füſsen z ruhten. Der auf der unteren Seite ebenfalls mit
Asbestpappe bekleidete Deckel hatte eine Oeffnung, in welche der Tiegel bequem
paſste, wenn derselbe auf dem mit einem Pfeifenthonrohre x umgebenen, dicken Eisendraht ruhte. Bei untergesetztem Dreibrenner
umspülten daher die heiſsen Gase den Tiegel gleichmäſsig, da sie durch den äuſseren
Ring b gezwungen waren, in der Pfeilrichtung wieder
nach unten zu gehen. Wenn das Doppelsalz geschmolzen war, wurde eine runde
Asbestplatte v aufgelegt und durch einen schweren
guſseisernen Ring f fest auf den Tiegelrand gedrückt.
Die Asbestplatte enthielt ein Thonrohr o (aus einem
galvanischen Elemente mit abgesprengtem Boden), in welches seitlich einige Löcher
gebohrt waren. In dem Thonrohre war mit Hilfe von Asbestplatten die als positive
Elektrode dienende Kohle, sowie das mit seitlichem Ansatze r versehene Rohr zur Abführung des Chlores befestigt. Diese Form des
Rohres wurde so gewählt, um etwaige Verstopfungen beseitigen und nach Abheben des
aufgesetzten Stopfens mit einem Streifen Lackmuspapier sich von der
Chlorentwickelung überzeugen zu können. Als negativer Pol diente ein 5mm dicker Eisendraht e, dessen unteres Ende die Kohle ringförmig umgab. Durch Rohr g wurde sehr langsam reducirendes oder indifferentes
Gas geleitet, welches durch Chlorcalcium getrocknet war und mit dem Chlor durch Rohr
r entwich. Bei Verwendung von Leuchtgas werden natürlich
Wasserstoff und die Kohlenwasserstoffe durch das Chlor zersetzt.
Zur Erzeugung der Elektricität diente eine 1pferdige Gaskraftmaschine von Gebrüder Körting in Hannover, welche eine
Dynamomaschine von Uppenborn und Gackenholz trieb;
letztere gab bei 9 bis 10 Volt Spannung etwa 50 Ampère. Bei Verwendung eines Tiegels
wurden im Durchschnitte 35, bei zwei hinter einander geschalteten Tiegeln je 22 bis
25, zusammen also 44 bis 50 Ampère nutzbar gemacht, somit stündlich bis 10g Magnesium ausgeschieden, das sich schwammförmig
auf der negativen Elektrode ansetzt, bei Hellrothglut aber zu Kugeln bis zu
Nuſsgröſse zusammenschmilzt, welche langsam an die Oberfläche steigen. Statt des
eisernen Ringes e kann man als negative Elektrode auch
eine Kohlenplatte verwenden, von welcher sich die Magnesiumkugeln noch leichter
lösen als von dem eisernen Ringe.
In dieser Weise ausgeführt, eignet sich die Herstellung des Magnesiums auch zu einem
Vorlesungsversuche. Auf eine ganze Reihe weiterer
in dieser Richtung ausgeführter Versuche will ich nicht eingehen, weil ich
schlieſslich zur Ueberzeugung kam, daſs die Magnesiumindustrie keine groſse Zukunft
haben wird, wenn nicht neue Verwendungen für Magnesium gefunden werden.
In erster Linie würde jedenfalls die Verwendung des Magnesiums zur Beleuchtung in Frage kommen. Nach Roscoe (1865 175 480) gaben
80g Magnesium soviel Licht als 10k Stearinkerzen; nach Frankland (Jahresbericht der chemischen
Technologie, 1866 S. 3) entsprechen 10k
Stearinkerzen etwa 79g Magnesium. Nach meinen
Versuchen sind für die Stunde und 100 Kerzen etwa 9g Magnesium erforderlich, so daſs 1k
Magnesium soviel Licht entwickelt als bei Verwendung der kleineren Siemens'schen Brenner 50cbm Leuchtgas (vgl. 1883 248 376). Da letztere
nur 8 M. kosten, so müſste 1k Magnesiumdraht, um
mit Leuchtgas und kleineren Siemens'schen Brennern
concurriren zu können, zu höchstens 8 M. geliefert werden, was aber wohl niemals
möglich sein wird. Dazu kommt, daſs Magnesium schon bei geringem Luftzuge verlöscht,
so daſs es in Laternen gebrannt werden muſs, deren Glasscheiben aber sehr bald von
der gebildeten Magnesia überzogen werden, welche die Lichtwirkung rasch auf die
Hälfte und weniger schwächen. Ferner würde es gewiſs schwierig sein, diesen
Magnesiastaub zu beseitigen, wenn das Magnesium etwa zur Straſsenbeleuchtung
verwendet werden sollte, wobei auch noch die Unterhaltung der zum Vorschieben des
Drahtes erforderlichen Uhrwerke zu berücksichtigen ist.
An eine Verwendung von Magnesium zu Beleuchtungszwecken ist daher nur in besonderen
Fällen (etwa für Kriegszwecke, Schiffe, Landpartien u.s.w.) zu denken.
Magnesium hat groſse Aehnlichkeit mit Zink und gibt dem entsprechend auch Legirungen
mit Kupfer. Es ist jedoch sehr wahrscheinlich, daſs Magnesium-Kupferlegirungen
weniger widerstandsfähig sind als Zink-Kupferlegirungen; jedenfalls sind sie aber erheblich theurer, so daſs auch hier keine
nennenswerthe Verwendung in Aussicht steht. Ich kann daher nicht dazu rathen, einen
groſsen Fabriksbetrieb auf Magnesium einzurichten,
bevor nicht neue Absatzquellen dafür geschaffen sind.
Tafeln