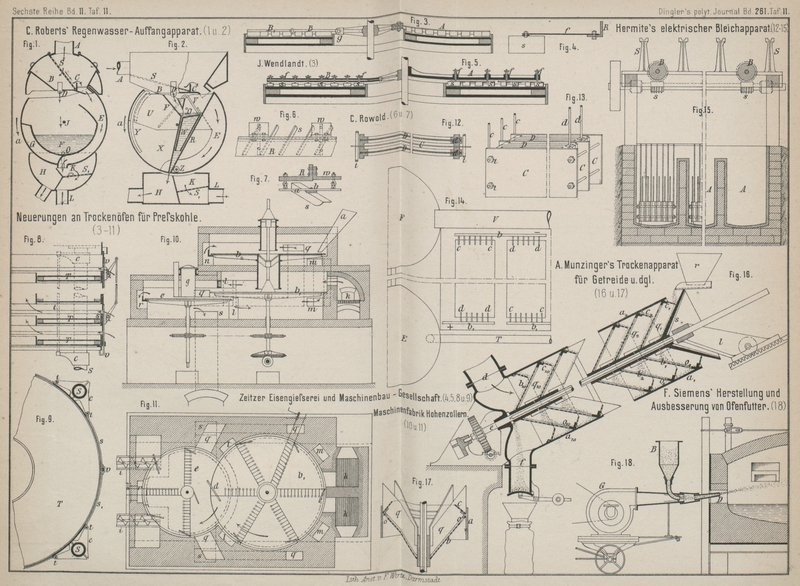
| Titel: | E. Hermite's Verfahren zum Bleichen von Faserstoffen. |
| Fundstelle: | Band 261, Jahrgang 1886, S. 180 |
| Download: | XML |
E. Hermite's Verfahren zum Bleichen von
Faserstoffen.
Mit Abbildungen auf Tafel
11.
Hermite's Verfahren zum Bleichen von Faserstoffen.
Zum Bleichen von Faserstoffen will E. Hermite in Paris
(* D. R. P. Kl. 8 Nr. 35549 vom 24. Oktober 1884) eine Chlormagnesiumlösung von 16° B. verwenden, welche elektrolytisch zerlegt wird. Ueber den damit gefüllten, aus
Cementmauerwerk hergestellten Küpen A (Fig. 15 Taf. 11) befindet
sich ein Holzgestell mit Walzen B, welche durch
Schnecken s getrieben werden. Träger S sollen die Walzen mit den zu bleichenden Stoffen (Garnsträhne oder Gewebewickel) aufnehmen. Die negative Elektrode besteht aus einer
Zinkplatte C (Fig. 13) mit angelöthetem
Kupferstreifen c und zwei Löchern an den Enden für die
Verbindungsbolzen t. Die positive Elektrode (vgl. Fig. 12 Taf.
11) besteht aus einer Platinplatte D, welche von einem
Holzrahmen umgeben und an einem Ende mit einem Kupferstreifen d verlöthet ist; letzterer wird mit dem Hauptleiter
verbunden. In dem Rahmen und rund um den Kupferstreifen d befindet sich ein hohler Raum, in welchen man Schwefel eingieſst,
welcher die Löthung vollkommen isolirt und sie unangreifbar macht. Der übrige Theil
des Kupferstreifens d wird durch einen Kautschuküberzug
isolirt.
Die Kupferstreifen der einzelnen Elektroden sind mit den Hauptleitern b bezieh. b1 (vgl. Fig. 14 Taf. 11)
verbunden. Das Rohr T führt die Chlormagnesiumlösung aus dem
Behälter E den Küpen A zu,
während durch die Rinne V die Flüssigkeit aus den Küpen
A in einen Behälter F
abgeleitet wird, um nach dem Absetzen durch eine Pumpe in den Behälter E zurückgeführt zu werden.
Sobald das Bad durch die Wirkung des elektrischen Stromes genügende Bleichkraft
erlangt hat, wovon man sich durch Versuche überzeugt, unterbricht man den Strom und
führt das Bleichen der auf den Walzen befindlichen Garnsträhnen, Gewebe o. dgl. in
der gewöhnlichen Weise durch. Man kann aber auch die in den verschiedenen Bottichen
elektrolytisch vorbereiteten Flüssigkeiten in einem einzigen Troge oder Bottiche
vereinigen, worin dann das Bleichen in gewöhnlicher Weise durchgeführt wird. Es ist
vortheilhaft, in dem Stromkreise einen Stromwender anzubringen, wodurch man von Zeit
zu Zeit und nur auf wenige Augenblicke den positiven Pol auf die negativen Platten
übertragen kann, so daſs jede etwa darauf entstandene Ablagerung entfernt wird.
Zum Bleichen von Papierstoff wird die
Chlormagnesiumlösung in einer Reihe von hinter einander geschalteten Trögen
elektrolysirt und dann auf den zu bleichenden Papierstoff gepumpt, oder man mischt
den Stoff mit der Chlormagnesiumlösung und elektrolysirt. (Vgl. E. Hermite 1885 256 * 558.
257 * 378.)
Die Zersetzungsverhältnisse erklärt Hermite in folgender Weise: Beim Einleiten des Stromes wird das
Chlormagnesium zersetzt und es bildet sich Unterchlorsäure und Magnesia. In
Gegenwart dieser Base spaltet sich die Säure in chlorige Säure und in Chlorsäure,
welche sich mit der Magnesia zu chlorsaurer und chlorigsaurer Magnesia verbinden.
Diese beiden Salze werden aber von dem elektrischen Strome wieder zersetzt und es
entsteht wieder freie Chlorsäure und chlorige Säure, während die Magnesia sich am
negativen Pole absetzt. Die beiden freien Säuren wirken nunmehr auf den im Elemente
enthaltenen organischen Stoff entfärbend ein, indem sie ihren Sauerstoff an
denselben abgeben. Das frei werdende Chlor verbindet sich mit dem auftretenden
Wasserstoffe zu Chlorwasserstoffsäure, welche sich mit der Magnesia wieder zu
Chlormagnesium verbindet, womit alsdann das Spiel von Neuem beginnen kann.
Der beschriebene Vorgang läſst sich nach Angabe Hermite's durch folgende Formeln ausdrücken:
2(MgCl.5 HO) = 2 MgCl + 10 HO = 2 MgO + 2 ClO4 + 10 H.
MgOClO5+ MgOClO3= 2 Mg + ClO5
+ ClO3 + 2 O.
Die 2 Aeq. Magnesium gehen zum negativen Pole und
bilden mit dem Sauerstoffe Magnesia. ClO5 und ClO3 geben ihren Sauerstoff an den färbenden Stoff der
zu bleichenden Pflanzenfaser ab, das frei werdende Chlor verbindet sich mit dem
freien Wasserstoffe zu Chlorwasserstoffsäure, welche sich wieder mit der Magnesia
zur Bildung des ursprünglichen Magnesiumchlorides verbindet. – Die Richtigkeit
dieser Erklärung ist noch zu beweisen (vgl. 1885 256 *
558).
Tafeln